您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2021-12-13 22:18
月度总结
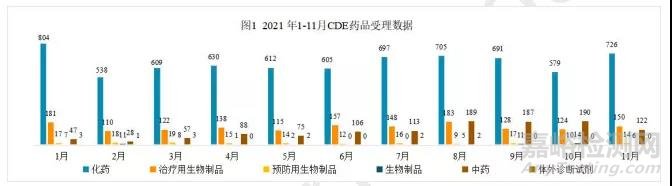
按数据统计分析,2021 年 11 月份药品审评中心(CDE)共承办 1018 个药品注册申请(按受理号计算)。
本月相比上月共增加了 101 个受理号,其中化学药品增加 147 个,生物药增加 22 个,中药减少 68 个。化学药品占比 71%,生物药占比 17%,其中治疗用生物制品申报数量达 88%,中药占比 12%。
1.化药审评情况
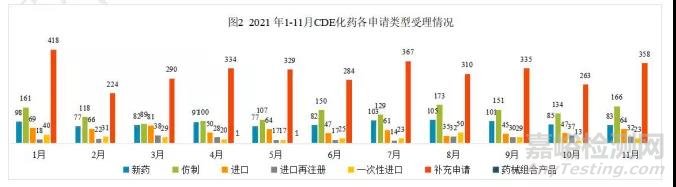
2021 年 11 月份 CDE 共承办新的化药注册申请有 726 个(按受理号计算)
国产化药1类申报情况
本月 CDE 受理国产化药注册 1 类新药共计 70 个受理号,涉及 38 个品种和 33家企业。
HLX208 片
RX-208(HLX208)是由苏州润新生物科技有限公司研发的是一种小分子药物,是一种B-raf 抑制剂。该药为中国化药一类。目前该药物最高研发阶段为临床二期,用于治疗黑色素瘤,脑癌,结直肠癌,非小细胞肺癌,甲状腺未分化癌,Erdheim-Chester 病,郎格罕细胞组织细胞增生症,朗格汉斯细胞肉瘤,甲状腺瘤和肾细胞癌。
研发里程碑:
2021 年 11 月 30 日,由上海复宏汉霖生物技术股份有限公司在中国大陆开展临床二期试验,用于治疗黑色素瘤。(NCT05114603)
2021 年 11 月 26 日,由上海复宏汉霖生物技术股份有限公司在中国大陆开展临床二期试验,用于治疗脑癌。(NCT05092802)
2021 年 11 月 17 日,由苏州润新生物科技有限公司在中国大陆开展临床二期试验,用于治疗结直肠癌。(CTR20212777)
2021 年 11 月 16 日,由苏州润新生物科技有限公司在中国大陆开展临床二期试验,用于治疗黑色素瘤。(CTR20212770)
2021 年 11 月 15 日,由上海复宏汉霖生物技术股份有限公司在中国大陆开展临床二期试验,用于治疗甲状腺未分化癌和非小细胞肺癌。(NCT05102292;NCT05065398)
2021 年 11 月 10 日,由上海复宏汉霖生物技术股份有限公司在中国大陆开展临床二期试验,用于治疗郎格罕细胞组织细胞增生症和 Erdheim-Chester 病。(NCT05092815)
2021 年 11 月 09 日,由上海复宏汉霖生物技术股份有限公司在中国大陆开展临床二期试验,用于治疗结直肠癌。(NCT05127759)
2021 年 10 月 14 日,由苏州润新生物科技有限公司在中国大陆开展临床二期试验,用于治疗朗格汉斯细胞肉瘤,脑癌和 Erdheim-Chester 病。(CTR20212459;CTR20212465)
2021 年 10 月 11 日,由苏州润新生物科技有限公司在中国大陆开展临床二期试验,用于治疗甲状腺瘤。(CTR20212412)
2021 年 08 月 26 日,由苏州润新生物科技有限公司在中国大陆开展临床二期试验,用于治疗非小细胞肺癌。(CTR20212076)
2021 年 08 月 11 日,由上海复宏汉霖生物技术股份有限公司在中国大陆开展临床二期试验,用于治疗肾细胞癌。(NCT04984369)
2019 年 12 月 11 日,由苏州润新生物科技有限公司在中国大陆开展临床一期试验,用于治疗实体瘤。(CTR20192492)
硝酮嗪肠溶片片
硝酮嗪是由暨南大学和广州喜鹊医药有限公司研发的是一种小分子药物,是一种 Proto- oncogene proteins c-akt 抑制剂和脑源性神经营养因子表达刺激剂。该药为中国化药一类。目前该药物最高研发阶段为临床二期,用于治疗糖尿病肾病,肌萎缩性侧索硬化,二型糖尿病和中风。
研发里程碑:
2021 年 06 月 18 日,由广州喜鹊医药有限公司在美国开展临床一期试验,用于治疗肌萎缩性侧索硬化。
2021 年 05 月 12 日,由广州喜鹊医药有限公司在中国大陆开展临床二期试验,用于治 糖尿病肾病。(CTR20210206)
2020 年 12 月 24 日,由广州喜鹊医药有限公司在中国大陆开展临床二期试验,用于治疗肌萎缩性侧索硬化。(CTR20202126)
2020 年 05 月 20 日,由广州喜鹊医药有限公司在中国大陆开展临床二期试验,用于治疗二型糖尿病。(CTR20192413;CTR20210206)
2019 年 07 月 01 日,由广州喜鹊医药有限公司在中国大陆开展临床二期试验,用于治疗中风。(CTR20190094)
2019 年 04 月 19 日,由广州喜鹊医药有限公司在中国大陆开展临床一期试验,用于治疗糖尿病肾病。(CTR20190583;CTR20212264)
2017 年 08 月 28 日,由广州喜鹊医药有限公司在中国大陆开展临床一期试验,用于治疗中风。(CTR20180766;CTR20170564;CTR20212371)
JAB-3312胶囊
JAB-3312是由北京加科思新药研发有限公司研发的是一种小分子药物,是一种SHP2抑制剂。该药为中国化药一类。目前该药物最高研发阶段为临床二期,用于治疗实体瘤。
研发里程碑:
2021年03月23日,由北京加科思新药研发有限公司在美国开展临床二期试验,用于治疗实体瘤。(NCT04720976)
2020年06月10日,由北京加科思新药研发有限公司在中国大陆开展临床一期试验,用于治疗胰腺导管癌,食管鳞状细胞癌,头颈部鳞状细胞癌,乳腺癌,结直肠癌,非小细胞肺癌和实体瘤。(CTR20192032;NCT04121286)
2019年09月26日,由北京加科思新药研发有限公司在美国开展临床一期试验,用于治疗胰腺导管癌,食管鳞状细胞癌,头颈部鳞状细胞癌,乳腺癌,结直肠癌,非小细胞肺癌和实体瘤。(NCT04045496)
2019年07月31日,由北京加科思新药研发有限公司向中国国家药品监督管理局NMPA提交IND申请,用于治疗结直肠癌和非小细胞肺癌,为中国化药一类。(CXHL1900250)
ACT001胶囊
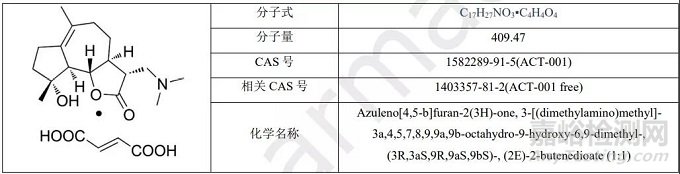
ACT-001是由天津尚德药缘科技股份有限公司研发的是一种小分子药物,是一种STAT3抑制剂和NF-κB抑制剂。该药为中国化药一类。目前该药物最高研发阶段为临床二期,用于治疗神经胶质瘤,非小细胞肺癌,肝细胞癌,黑色素瘤,乳腺癌,中枢神经系统肿瘤,胶质母细胞瘤,视神经脊髓炎和视神经炎。
研发里程碑:
2021年09月22日,由Accendatech USA Inc在美国开展临床二期试验,用于治疗神经胶质瘤。(NCT05053880)
2021年03月11日,由天津辛夷尚德生物医药科技有限公司在中国大陆开展临床二期试验,用于治疗黑色素瘤,肝细胞癌,乳腺癌和非小细胞肺癌。(CTR20201657)
2020年10月15日,由天津辛夷尚德生物医药科技有限公司在中国大陆开展临床二期试验,用于治疗中枢神经系统肿瘤。(CTR20200518)
2020年06月30日,由天津尚德药缘科技股份有限公司在中国大陆开展临床二期试验,用于治疗胶质母细胞瘤。(CTR20201204;CTR20202393)
2020年05月27日,由天津尚德药缘科技股份有限公司和洛阳尚德药缘科技有限公司在中国大陆开展临床二期试验,用于治疗视神经脊髓炎和视神经炎。(CTR20191626)
2019年05月13日,由天津尚德药缘科技股份有限公司和洛阳尚德药缘科技有限公司向中国国家药品监督管理局NMPA提交IND申请,用于治疗视神经脊髓炎,为中国化药一类。(CXHL1900032)
2018年01月15日,由天津尚德药缘科技股份有限公司在中国大陆开展临床一期试验,用于治疗胶质瘤。(CTR20171274)
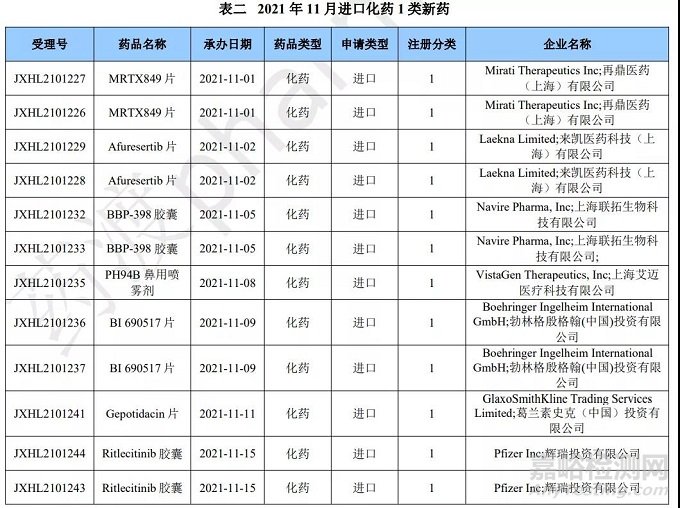
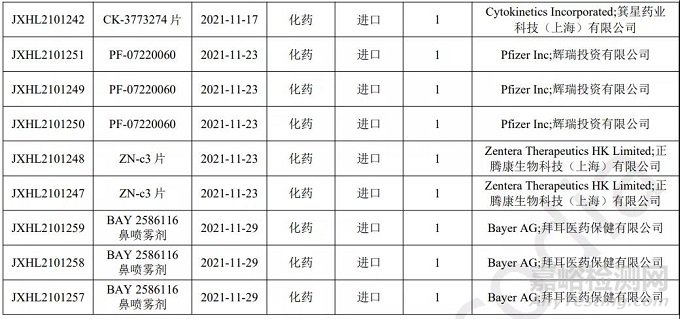
化药进口1类申报情况
本月 CDE 受理进口化药注册1类新药共计21个受理号,涉及12个品种和20家企业。
2.生物制品审评情况
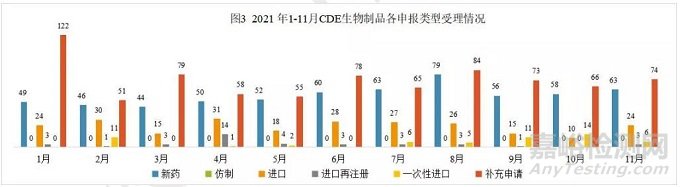
2021年11 月份CDE 共承办新的生物制品注册申请有170个(按受理号计算),新药63个,进口24个,一次性进口6个,补充申请74个。
国产生物制品注册1类申报情况
本月 CDE 受理国产生物制品注册1类新药共计44个受理号,涉及36个品种和34家企业。
泰特利单抗注射液
泰特利单抗是由四川科伦博泰生物医药股份有限公司研发的是一种人源化单克隆抗体,是一种 PD-L1 抑制剂。该药为中国生物药一类。目前该药物最高研发阶段为申请上市,用于治疗鼻咽癌。
研发里程碑:
2021年11月19日,由四川科伦博泰生物医药股份有限公司向中国国家药品监督管理局NMPA提交上市申请,用于治疗鼻咽癌。(CXSS2101052)
2019年09月26日,由四川科伦博泰生物医药股份有限公司在中国大陆开展临床二期试验,用于治疗淋巴瘤。(CTR20192416)
2019年03月06日,由四川科伦博泰生物医药股份有限公司在中国大陆开展临床二期试验,用于治疗鼻咽癌。(CTR20190152)
2019年02月28日,由四川科伦药物研究院有限公司开展临床二期试验,用于治疗鼻咽癌。(NCT03848286)
2018年09月27日,由四川科伦博泰生物医药股份有限公司在中国大陆开展临床一期试验,用于治疗B-细胞淋巴瘤和结外NK-T细胞淋巴瘤。(CTR20181491)
2018年08月01日,由四川科伦博泰生物医药股份有限公司在中国大陆开展临床二期试验,用于治疗霍奇金病。(CTR20180954)
2018年07月30日,由四川科伦药物研究院有限公司开展临床二期试验,用于治疗霍奇金病。(NCT03580564)
2018年03月19日,由四川科伦博泰生物医药股份有限公司在中国大陆开展临床一期试验,用于治疗淋巴瘤。(CTR20181197)
2018年01月10日,由四川科伦博泰生物医药股份有限公司在中国大陆开展临床一期试验,用于治疗实体瘤。(CTR20181198)
QX005N注射液
QX-005N是由江苏荃信生物医药有限公司研发的是一种生物药,是一种IL4RA抑制剂。该药为中国生物药一类。目前该药物最高研发阶段为临床二期,用于治疗特应性皮炎。
2021年11月17日,由江苏荃信生物医药有限公司在中国大陆开展临床二期试验,用于治疗特应性皮炎。(CTR20211996)
2020年11月02日,由江苏荃信生物医药有限公司在中国大陆开展临床一期试验,用于治疗特应性皮炎。(CTR20201779)
2020年04月15日,由江苏荃信生物医药有限公司向中国国家药品监督管理局NMPA提交IND申请,用于治疗特应性皮炎,为中国生物药一类。(CXSL2000066)
GR1501注射液
GR-1501是由智翔(上海)医药科技有限公司和重庆智翔金泰生物制药有限公司研发的是一种单克隆抗体和重组蛋白,是一种IL17A抑制剂。该药为中国生物药一类。目前该药物最高研发阶段为临床三期,用于治疗斑块银屑病。
研发里程碑:
2021年03月09日,由智翔(上海)医药科技有限公司和重庆智翔金泰生物制药有限公司在中国大陆开展临床三期试验,用于治疗斑块银屑病。(CTR20210246)
2020年09月16日,由智翔(上海)医药科技有限公司和重庆智翔金泰生物制药有限公司在中国大陆开展临床二期试验,用于治疗椎关节炎。(CTR20201602)
2019年08月30日,由智翔(上海)医药科技有限公司和重庆智翔金泰生物制药有限公司在中国大陆开展临床一期试验,用于治疗银屑病。(CTR20191529)
2018年07月30日,由智翔(上海)医药科技有限公司和重庆智翔金泰生物制药有限公司在中国大陆开展临床一期试验,用于治疗斑块银屑病。(CTR20181154)
2017年07月21日,由智翔(上海)医药科技有限公司和重庆智翔金泰生物制药有限公司向中国国家药品监督管理局NMPA提交IND申请,用于治疗椎关节炎和银屑病,为中国生物药一类。(CXSL1700066)
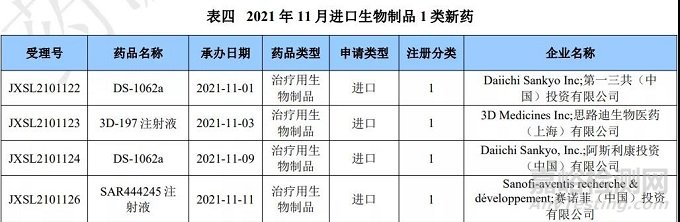
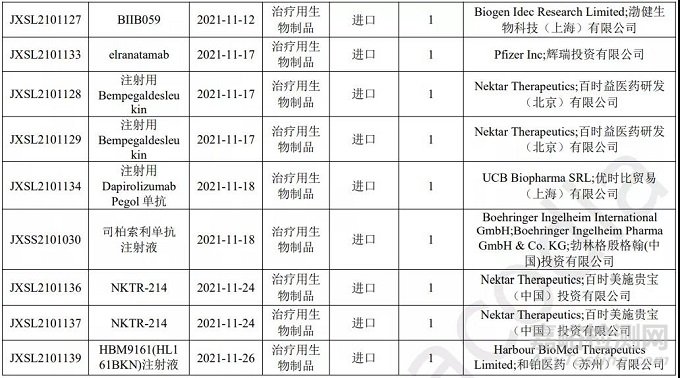
进口生物制品注册1类申报情况
本月 CDE 受理进口生物制品注册1类新药共计13个受理号。涉及10个品种和21家企业。
3.中药审评情况
2021年11月份CDE 共承办新的中药注册申请有122个(按受理号计算)。
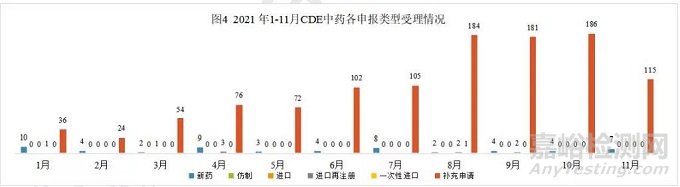
中药注册申报情况
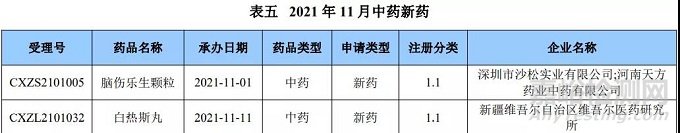
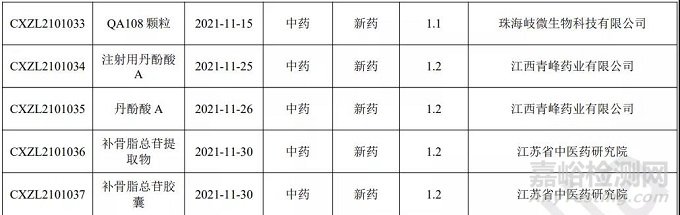
本月 CDE 受理中药注册1类新药共计7个受理号,涉及7个品种和6家企业。
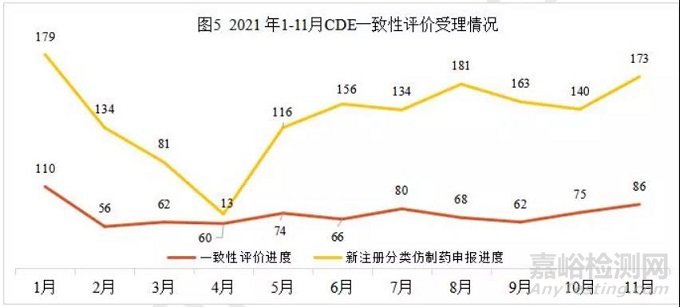
按一致性评价申报情况
本月新增86个按一致性评价要求进行申报的受理号。

来源:Internet


