您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-31 15:59
一、前言
在药品生命周期中将某一药品的知识、生产工艺、分析方法、包装组分及其他任何步骤或工艺从转移方转移到一个新的场所(即转入方)的过程,称为药品技术转移(Technology Transfer)。
药品技术转移可以发生在“上市前阶段”,比如从研发到生产的转移或同一企业内不同场地的转移,也可发生在“上市后阶段”,比如同一企业内不同生产场地的转移或不同企业之间的生产场地转移。
技术转移内容包括生产工艺转移和分析方法转移。其中分析方法转移(analytical method transfer),是一个文件记录和实验确认的过程,目的是证明一个实验室(方法接收实验室)在采用另一实验室(方法建立实验室)建立并经过验证的非法定分析方法检测样品时,该实验室有能力成功地操作该方法,检测结果与方法建立实验室检测结果一致。
基于此,本文对技术转移中分析方法转移的几个关注点进行如下总结。
二、 分析方法转移的关注点
2.1 发生阶段
2.1.1 从研发实验室到QC实验室(比如,创新药临床试验用药品的制备,要求在GMP条件下生产,在IND申报完成并获得默许后,申办方可以将企业内研发实验室质控方法转移至工厂QC实验室,也可以由申办方研发实验室转移到合同生产商的研发实验室,再由研发实验室转移到QC实验室,等等);
2.1.2 场地变化(同一企业或不同企业之间,不同合同生产商之间的分析方法转移);
2.1.3 委托检验(有些研发实验室开发的分析方法,QC实验室不具备检验条件,需要委托有资质的第三方进行检验,比如放行标准中的基因毒检验方法,采用LC-MS/MS或GC-MS/MS,一般工厂QC实验室不具备)。
2.2 基本流程
基于项目管理,包括文件转移、预实验、实施前的准备、分析方法转移的实施和分析方法转移收尾五个过程组。
2.2.1 文件转移
由转出方汇总整理转移项目分析方法相关资料或对照品(技术包),与转入方进行交接(接收单),包括但不限于以下文件:
Ø 起始原料、包装材料的质量标准;
Ø 中控及成品的质量标准;
Ø 代表性批次的检验报告;
Ø 各检验样品的取样方法;
Ø 以上方法的建立、优化及方法学验证资料;
Ø 对照品的来源及证明文件、实物样品。
2.2.2 预实验
转入方接收技术文件后会进行系统的分析评估,并进行预实验,该过程关注点包括以下几点:
Ø 与工艺转移的小试实验同步进行;
Ø 或者采用转出方的留样、对照品、加标样品等进行方法重现;
Ø 转出方应对转入方进行培训、实验指导及技术答疑;
Ø 转入方尽早发现问题,双方探讨解决方案;
Ø 确认人员资质、仪器设备是否满足检验要求;
Ø 确认仪器设备是否在校验有效期内;
Ø 确认实验室管理体系符合法规要求和内部管理规定。
2.2.3 实施前的准备
基于预实验结果会形成分析方法转移的风险评估报告,并制定分析方法转移方案。转移方案内容会涉及转移目的、范围、双方职责、使用的材料和仪器、分析方法、实验设计、可接受标准、报告要求(数据、图谱)、偏差处理、参考文献、附件等内容。其中可接受标准可参考《分析方法转移内容介绍》许明哲等,药物分析杂质,2015,35(1)。比如,转移原料药的含量测定方法(HPLC,GC,CE),对比实验法,要求转出方和转入方平均值偏差不大于2.0%,Srel(中间精密度,n=6)不大于2.0%。
2.2.4 实施过程
(1)转移类型
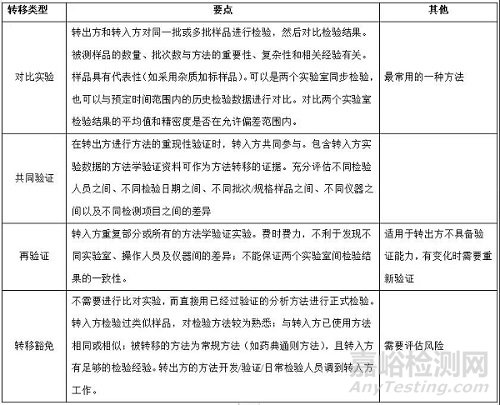
(2)转移类型的选择原则
Ø 转入方实验室的检验能力;
Ø 转入方实验室的检验经验;
Ø 转入方与转出方实验室的检验仪器设备的差异(仪器品牌型号、色谱柱品牌类型等);
Ø 分析方法的复杂程度(如避光操作、前处理复杂);
Ø 被测样品的特性(如稳定性差的样品)。
(3)分析方法转移的实施过程
Ø 与工艺转移中的试生产同步进行;
Ø 应有转出方人员进行现场指导,提供技术支持;
Ø 严格按照已批准的转移方案执行;
Ø 实验中若出现偏差,应进行偏差记录和报告,并评估该偏差对实验结果是否有影响;
Ø 若实验结果不符合可接受标准,双方共同调查分析原因,并采取补救措施;
Ø 根据实施情况,双方共同决定是否需要变更分析方法,若需要则应启动变更程序。
2.2.5 收尾
分析方法转移收尾阶段,对转移实施过程中产生的数据进行收集,实验结果符合方案中预设的可接受标准,根据实验结果给出转移的评价与结论,说明转入方能成功操作该分析方法,该分析方法在转入方能用于检验和控制产品质量,以此标志着分析方法转移完成。
在整个分析方法转移过程,会产生很多文件,可由QA部门进行整理,形成档案。
文件内容包括但不限于:
Ø 分析方法相关的技术资料包;
Ø 风险评估报告;
Ø 培训计划及记录;
Ø 检验操作规程;
Ø 批检验记录样稿;
Ø 分析方法转移方案和报告;
Ø 起始原料、包装材料、中控及成品的质量标准;
Ø 变更控制文件。
三、总结
技术转移是药品生命周期中必不可少的一项内容,也是一个系统性的工程,其中分析方法转移是保证检验结果质量,保证不同实验室之间得到一致、可靠和准确检验结果的一个重要环节,同时也是对实验室检验能力的一个重要评估,需要同步考虑生产工艺转移,以项目管理的方式实行,应引起企业足够的重视。
1、 参考文献
[1]《药品技术转让注册管理规定》(国食药监注[2009]518号)
[2]《国家食品药品监督管理局关于做好实施新修订药品生产质量管理规范过程中药品技术转让有关事项的通知》(国食药监注[2013]38号)
[3]《食品药品监管总局办公厅关于实施新修订药品生产质量管理规范过程中药品技术转让工作有关要求的通知》(食药监办药化管[2013]101号)
[4]《食品药品监管总局办公厅关于注射剂等无菌药品技术转让有关事项的通知》(食药监办药化管[2014]203号)
[5]《食品药品监管总局办公厅关于药品技术转让有关事项的通知》(食药监办药化管[2017]29号)
[6]《新药研发生产技术转移指导原则》(2012年征求意见稿)
[7]《分析方法转移指导原则》2020版中国药典四部通则9100
[8]WHO:第961号技术报告附件7药物生产技术转移指南(2011)
[9]ISPE(国际制药工程协会):Technology Transfer,2nd(2014)
[10]PDA(美国注射剂协会):第65号技术报告,Technology Transfer(2014)
[11]USP<.1224>方法转移

来源:药研


