您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-01-11 15:01
2022.1.4,欧盟公报上发布了委员会执行决定(EU) 2022/6,修订2021.7.16执行决定(EU) 2021/1182,涉及医疗器械生物评价、医疗保健产品灭菌、医疗保健产品无菌处理、质量管理体系、制造商提供的信息中使用的符号、医疗保健产品的处理及家用光疗设备的协调标准。
此次执行决定新增了MDR法规下的9个协调标准,包括如下:
2021.7.16执行决定(EU) 2022/6下的MDR协调标准包括以下5个:

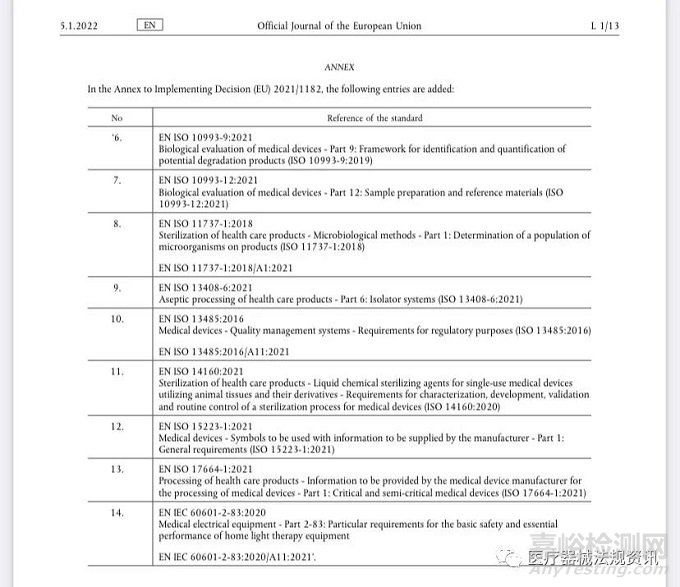
因此,目前MDR协调标准总共有14个,涉及以下相关标准:
医疗器械生物评价:
1. EN ISO 10993-9:2021,Biological evaluation of medical devices — Part 9: Framework for identification and quantification of potential degradation products(医疗器械生物学评价第9部分,潜在降解产品的定性和定量的框架),等同于ISO 10993-9:2019,这个标准提供了通过设计和进行体外降解研究对医疗器械降解进行系统性评估的基本原则。适用于预期和非预期在体内降解的材料。
2. EN ISO 10993-12:2021,Biological evaluation of medical devices — Part 12: Sample preparation and reference materials(医疗器械生物学评价第12部分,样品制备和参考材料),等同于ISO 10993-12:2021,这个标准规定了在生物试验系统中进行医疗器械试验的样品制备和参考材料选择程序的要求,并提供了指南。
3. EN ISO 10993-23:2021,Biological evaluation of medical devices — Part 23: Tests for irritation(医疗器械生物学评价第23部分,刺激测试),等同于ISO 10993-23:2021,这个标准规定了评估医疗器械及其组成材料产生刺激的可能性的程序。
医疗保健产品灭菌:
1. EN ISO 11737-1:2018/A1:2021,Sterilization of health care products. Microbiological methods. Determination of a population of microorganisms on products(医疗保健产品灭菌.微生物学方法.产品上微生物群落的测定),等同于ISO 11737-1:2018,规定了医疗保健产品、部件、原材料或包装内或表面活的微生物群落的计数或微生物学表征的要求,并提供了指导。
2. EN ISO 14160:2021,Sterilization of health care products- Liquid chemical sterilizing agents for single-use medical devices utilizing animal tissues and their derivatives - Requirements for characterization, development, validation and routine control of a sterilization process for medical device(医疗保健产品的灭菌-使用动物组织及其衍生物的单次使用的医疗器械所用的液体化学灭菌试剂-医疗器械注册灭菌过程的表征、开发、确认、以及日常控制),等同于ISO 14160:2020。
3. EN ISO 11135:2014/A1:2019,Sterilization of health-care products - Ethylene oxide - Requirements for the development, validation and routine control of a sterilization process for medical devices - Amendment 1: Revision of Annex E, Single batch release(环氧乙烷灭菌过程的开发、确认、以及日常控制,修正1:更新附录E),等同于ISO 11135:2014/Amd 1:2018。
4. EN ISO 11137-1:2015/A2:2019,Sterilization of health care products - Radiation - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices - Amendment 2: Revision to 4.3.4 and 11.2 (辐照灭菌过程的开发、确认和日常控制),等同于ISO 11137-1:2006/Amd 2:2018。
5. EN ISO 11737-2:2020,Sterilization of health care products - Microbiological methods - Part 2: Tests of sterility performed in the definition, validation and maintenance of a sterilization process(在定义、确认和维护灭菌过程中进行的使用微生物法的无菌测试),等同于ISO 11737-2:2019。
6. EN ISO 25424:2019,Sterilization of health care products - Low temperature steam and formaldehyde - Requirements for development, validation and routine control of a sterilization process for medical devices (低温蒸汽和甲醛灭菌过程的开发、确认和日常控制),等同于ISO 25424:2018。
医疗保健产品无菌处理:
EN ISO 13408-6:2021,Aseptic processing of health care products – Part 6: Isolator systems (隔离系统的无菌处理),等同于ISO 13408-6:2021。
质量管理体系:
EN ISO 13485:2016/A11:2021,Medical devices – Quality management systems – Requirements for regulatory purposes,等同于ISO 13485:2016。
制造商提供的信息中使用的符号:
EN ISO 15223-1:2021
医疗保健产品的处理:
EN ISO 17664-1:2021,Processing of health care products Information to be provided by the medical device manufacturer for the processing of medical devices Part 1: Critical and semi-critical medical devices(制造商提供的关键和半关键医疗器械的处理相关信息),等同于ISO 17664-1:2021。
家用光疗设备:
EN IEC 60601-2-83:2020/A11:2021,Medical electrical equipment – Part 2-83: Particular requirements for the basic safety and essential performance of home light therapy equipment(家用光疗设备的专标),等同于IEC 60601-2-83:2019。

来源:医疗器械法规资讯


