您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-14 10:12
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.辉瑞新冠口服药中国获批上市。2月11日,NMPA应急附条件批准辉瑞新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(商品名:Paxlovid)进口注册。Paxlovid由300mg(两片150mg片剂)3CL蛋白酶抑制剂nirmatrelvir和一片100mg利托那韦片组合给药,供伴有进展为重症高风险的轻中度COVID-19患者口服,每日给药2次,持续5天。在症状出现三天内接受治疗的患者中,Paxlovid可使COVID-19相关的住院或死亡风险降低89%。
2.和黄FIC肿瘤药启动国际Ⅲ期临床。Epizyme公司开发的EZH2抑制剂tazemetostat在中国登记启动一项国际Ⅲ期临床,评估tazemetostat或安慰剂联合来那度胺+利妥昔单抗对复发/难治性滤泡性淋巴瘤患者的安全性和有效性。tazemetostat是首款获FDA批准的EZH2抑制剂,已获批用于治疗上皮样肉瘤和复发/难治性滤泡性淋巴瘤。去年8月,和黄医药通过高达3.1亿美元的合作获得tazemetostat在大中华区的开发和商业化权利。
3.康宁杰瑞双抗上胰腺癌III期临床。康宁杰瑞PD-L1/CTLA-4双抗KN046联合白蛋白紫杉醇与吉西他滨一线治疗晚期胰腺癌的Ⅲ期注册临床(KN046-303)完成首例患者给药。该项研究由上海长海医院金钢医学博士和中国人民解放军总医院徐建明医学博士共同担任主要研究者,计划入组408例受试者,评估KN046用于联合治疗的有效性和安全性。主要研究终点为经IRC评估的无进展生存期(PFS)和总生存期(OS)。
4.上海健信PD-1/TIM3双抗获批临床。健信生物注射用重组抗PD-1/TIM3人源化双特异抗体(Bis5)获国家药监局临床试验默示许可,拟开发用于晚期恶性肿瘤的治疗。Bis5序列为特异对称结构,针对双靶点具有同等亲和力,且具有DC细胞、NK细胞、T细胞活性。在临床前研究中,针对PD-1抑制剂单药,以及PD-1抑制剂与TIM3单抗联用均无效的肿瘤,Bis5显示出显著抑制肿瘤和延迟生存期的效果。此前,Bis5已在美获批临床。
5.齐鲁锐格CDK2/4/6抑制剂国内报IND。齐鲁锐格首个创新抗肿瘤候选药物RGT-419B的临床试验申请获CDE受理。RGT-419B是新一代CDK2/4/6小分子抑制剂。在临床前研究中,RGT-419B显示出单药活性,对ER+肿瘤细胞生长的抑制作用较大;在对CDK4/6抑制剂耐药的ER+乳腺癌细胞中,RGT-419B显示出对癌细胞的完全抑制;并具有与雌激素受体降解剂或PI3K抑制剂联用时协同抑制肿瘤的潜力。去年年底,该新药已获得FDA的临床许可。
国际药讯
1.基因泰克两款眼科抗体长期疗效积极。罗氏制药旗下基因泰克两款眼科疗法Vabysmo(faricimab-svoa)和Susvimo(ranibizumab injection)在三项Ⅲ期临床中获得最新的2年数据。Susvimo是FDA批准的首款可只需每年接受两次治疗的湿性年龄相关性黄斑变性(AMD)疗法。Vabysmo是首款获FDA批准治疗AMD和糖尿病性黄斑水肿(DME)的双抗疗法。这些长期结果进一步支持这两种疗法能够以更长的治疗间隔时间、和更少的眼部注射频率治疗患者,同时仍达到与当前标准治疗类似的视力改善。
2.Keytruda组合治疗早期三阴性乳腺癌成果发表。默沙东PD-1抗体Keytruda治疗早期三阴性乳腺癌的Ⅲ期临床成果发表在《新英格兰医学杂志》上。与化疗+安慰剂组相比,Keytruda联合化疗用于术前新辅助治疗以及在术后单药辅助治疗,显著延长患者的无事件生存期(EFS),将疾病进展风险降低了37%(HR=0.63,[95% CI,0.48-0.82];p=0.00031);两组3年EFS率预估为84.5%(95% CI,81.7-86.9)和76.8%(95% CI,72.2-80.7)。去年7月,Keytruda用于上述适应症已获FDA批准。
3.再生元高剂量阿柏西普Ⅱ期临床积极。再生元新型浓缩高剂量制剂aflibercept与已获批2 mg剂量aflibercept(Eylea)相比,在治疗湿性年龄相关性黄斑变性(AMD)的概念验证Ⅱ期临床达到主要安全性终点。试验未观察到新的安全性信号。与对照组相比,Aflibercept(8 mg)组患者第44周时视网膜中央子域无液体的比例更高(40%vs28%,p=0.2185);两组ETDRS字母测量分别改善7.9个和5.1个(p=0.1957)。Aflibercept(8 mg)治疗湿性AMD和糖尿病性黄斑水肿(DME)的Ⅲ期临床结果预计今年下半年获得。
4.Dupixent治疗婴幼儿皮炎获优先审评资格。FDA授予赛诺菲与再生元开发的重磅IL-4/IL-13抑制剂度普利尤单抗(Dupixent)的补充生物制品许可申请(sBLA)优先审评资格,用于添加维持治疗6个月至5岁中重度特应性皮炎儿童患者。在一项Ⅲ期试验中,与标准治疗相比,Dupixent联合皮质类固醇显著提高第16周皮肤达到病症完全清除或几乎完全清除的患者比例(28%vs4%),两组患者实现EASI-75的比例分别为53%和11%(p≤0.0001),而且安全性数据与成人的安全性相当。
5.拜耳FXIa抑制剂获快速通道资格。FDA授予拜耳口服因子XIa(FXIa)抑制剂asundexian快速通道资格(FTD),拟用于非心源性缺血性卒中(NCIS)患者的二级预防。Asundexian被开发用于治疗NCIS患者,心房颤动(心律不齐)和近期心肌梗死(心脏病发作)3种适应症目前已处于Ⅱ期临床阶段。asundexian对FXIa的抑制,被认为可在不增加出血风险的情况下提供血栓事件的保护。
6.阿斯利康终止开发改良型新冠疫苗。阿斯利康在2021年财报中披露,已终止针对Beta变异株的改良型新冠疫苗AZD2816的开发。放弃原因是因为目前在全球疫情中占主导地位的是“奥密克戎”变异株;而且AZD2816与其已上市的第一代新冠疫苗Vaxzevria免疫原性没有显著差异,没有必要从一种疫苗转换到另一种疫苗。根据财报,阿斯利康2021年共供应了25亿剂疫苗,收入达到39.81亿美元。
医药热点
1.医疗机构设置规划指导原则出台。国家卫健委日前印发《医疗机构设置规划指导原则(2021—2025年)》指出,2025年全国医疗机构设置规划主要指标中,千人口床位数的指导性要求为7.4~7.5床,每千人口执业(助理)医师数(人)3.2人,二级及以上综合医院设置老年医学科的比例不低于60%,县办综合医院适宜床位规模为600~1000床,市办综合医院适宜床位规模为1000~1500床,省办及以上综合医院适宜床位规模为1500~3000床。
2.浙大一院江西医院正式开工。近日,浙江大学医学院附属第一医院江西医院建设工作全面启动,旨在依托南昌大学第二附属医院,共同打造以“心血管、神经、肿瘤”三大学科群为主体,其他学科协同发展的综合性国家区域医疗中心。浙大一院江西医院计划分两期建设,设置床位数1200张。一期位于红谷滩区学府大道588号,毗邻南昌大学第二附属医院红角洲院区;二期位于南昌市九龙湖片区,拟重点打造成为国际化肿瘤诊治中心。
3.海南为民办8项卫生健康实事。海南省日前发布《省委、省政府2022年为民办实事事项》,9项实事事项中,有8项与卫生健康工作相关。2022年,海南省计划安排省级财政资金4984.2万元,为适龄女生提供国产2价HPV疫苗;630万元用于建立完善新生儿先心病筛查、诊断和治疗一体化服务体系;1972万元用于开展失能老人认知障碍筛查;3000万元用于为精神障碍患者新增1万个门诊免费服用基药名额;3722万元用于1781所小学和80家A级旅游景区各配备一台自动体外除颤仪等。
评审动态
2. FDA新药获批情况(北美02月11日)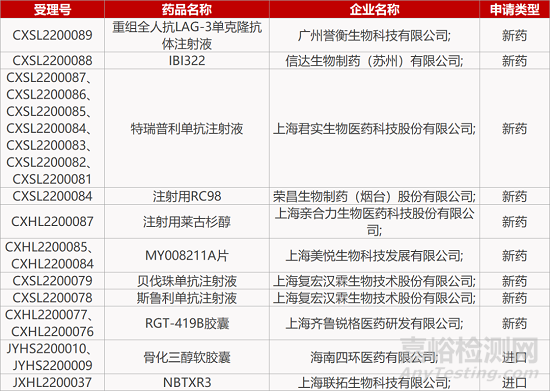
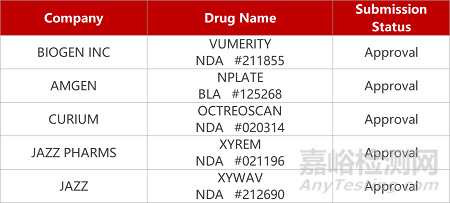

来源:药研发


