您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-22 11:45
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
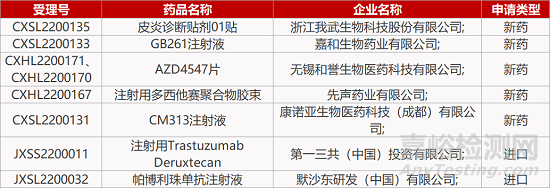
1.阿斯利康/第一三共ADC国内报NDA。阿斯利康与第一三共联合开发的重磅ADC疗法Enhertu (trastuzumab deruxtecan)的上市申请获CDE受理。这是一款基于第一三共专有的DXd ADC技术开发的靶向HER2的抗体偶联药物(ADC),已于2019年12月获FDA批准上市,用于治疗既往已经接受2种及以上HER2靶向疗法的不可切除或转移性HER2阳性乳腺癌;以及用于治疗既往接受过基于曲妥珠单抗治疗的局部晚期或转移性HER2阳性胃或胃食管交界处腺癌。
2.再鼎尼拉帕利卵巢癌Ⅲ期临床积极。再鼎医药口服PARP抑制剂尼拉帕利用于维持治疗晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌(统称为卵巢癌)的Ⅲ期临床PRIME积极结果公布在美国妇科肿瘤学会(SGO)年会上。与安慰剂相比,尼拉帕利维持治疗显著改善全人群的PFS(中位PFS:24.8个月vs8.3个月);尼拉帕利的安全性与先前研究一致。目前总体生存数据尚未成熟。
3.康方PD-1/CTLA-4双抗Ⅱ期临床积极。康方生物在2022SGO年会上公布PD-1/CTLA-4双抗卡度尼利单抗二、三线单药治疗复发/转移性宫颈癌的Ⅱ期研究(201研究)积极结果。卡度尼利单抗经IRRC确认的ORR达到33.0%(95%CI,23.9%-43.1%),中位PFS达到3.75个月(95%CI,2.00-6.41),中位OS达到17.51个月(95%CI,11.37-NE)。而且卡度尼利单抗总体耐受性良好。此前,FDA已授予卡度尼利单抗用于复发或转移性宫颈癌的快速通道资格。
4.GSK长效IL-5拮抗剂在华获批临床。葛兰素史克长效IL-5拮抗剂depemokimab注射液获国家药监局临床试验默示许可,拟用于治疗嗜酸性肉芽肿性多血管炎。depemokimab有望实现每6个月注射一次就可控制患者症状。目前该新药正在海外针对嗜酸性肉芽肿性多血管炎、重度嗜酸粒细胞性哮喘、慢性鼻窦炎伴鼻息肉等多种不同适应症展开Ⅲ期临床试验。
5.传奇生物2021年财报出炉。3月18日,传奇生物公布2021年财报,全年收入8980万美元;研发费用为3.133亿美元,同比增加8110万美元;销售和分销费用为1.025亿美元,同比增加5290万美元,主要是增加Cilta-cel发布相关商业准备活动费用。Cilta-cel是首款获得FDA批准的国产CAR-T细胞疗法,已于去年3月1日获批上市,用于四线或以上治疗复发或难治性多发性骨髓瘤 (MM) 。目前,传奇生物尚未取得产品销售收入。
国际药讯
1.阿斯利康长效新冠鸡尾酒获英国批准。英国药品和保健产品监管机构(MHRA)批准阿斯利康长效抗体组合疗法Evusheld用于COVID-19的暴露前预防。目前,疫苗接种是英国大多数人的主要保护措施。但针对不太可能对COVID-19疫苗接种产生充分反应的成人(包括不建议接种疫苗的成人),一次性肌肉注射Evusheld使症状性COVID-19风险降低83%,并能够持续6个月的防护免疫效果。
2.全球首款FRα-ADC将在美报BLA。ImmunoGen公司FRα-ADC新药IMGN853治疗FRα高表达的铂耐药卵巢癌的关键临床(SORAYA)结果积极。IMGN853单药达到确认的客观缓解率为32.4%,包括5个完全缓解(CR);中位缓解持续时间为6.9 个月;IMGN853总体安全性和耐受性良好。预计本月向FDA递交生物制品许可申请(BLA)。据悉,这是全球首个针对FRα的ADC药物,华东医药拥有IMGN853在中国的开发和商业化权益。
3.罗氏SMA口服疗法长期疗效积极。罗氏旗下基因泰克口服SMN2剪接调节剂Evrysdi(risdiplam)治疗脊髓性肌萎缩症(SMA)的Ⅱ/Ⅲ期临床新数据积极。接受Evrysdi治疗的患者中,运动功能量表-32(MFM-32)总分在治疗第1年后观察到的改善在第3年时仍然得到维持;修订的上肢模块测试(RULM)和汉默史密斯功能运动量表(HFMSE)总分较基线的增加也得到维持;3年期间,Evrysdi总体耐受性良好。此外,该试验第2部分的探索性2年疗效数据证明,与对照组相比,Evrysdi可改善或稳定患者运动功能。
4.全人源IL-12靶向融合蛋白获批临床。Sonnet公司基于全人源白蛋白结合FHAB™技术开发的IL-12靶向疗法SON-1010获FDA临床许可,拟用于治疗实体瘤。Sonnet专有的白蛋白结合单链抗体片段(scFv)支架可连接一种或两种有效载荷;FHAB结构包含一个设计用于与人血清白蛋白结合并“搭便车”的结构域。IL-FHAB通过与人血液中白蛋白结合,再与与肿瘤组织高表达的FcRn结合,之后选择性与肿瘤细胞表面高表达的GP60、SPARC结合,最后释放有效载荷杀死肿瘤细胞。
5.FDA批准NGS癌症基因组检测。Foundation公司基于下一代基因测序(NGS)的体外诊断检测FoundationOne CDx获FDA批准作为伴随诊断,确定肿瘤具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)改变的非小细胞肺癌(NSCLC)患者,这些患者适合使用FDA批准用于该适应症的EGFR酪氨酸激酶抑制剂(TKI)进行治疗。FoundationOne CDx能够检测324个基因中发生的置换、插入、缺失,和基因拷贝数目变化(CNAs),以及部分基因重排。
6.精准医疗研发公司Deepcel完成B轮融资。Deepcell公司宣布完成7300万美元的B轮融资。Deepcell利用AI驱动的成像和微流体技术平台,能够在没有固有偏倚的情况下对细胞进行分类,其单细胞分析的灵敏度可以在10亿个细胞中发现1个罕见细胞。本轮融资将用于推动其单细胞分析技术平台的开发,以及用于支持该公司将新发现应用于诊断检测和精准疗法开发。
7.渤健放弃开发dAMD候选药物。渤健宣布终止与Catalyst Biosciences公司关于干性年龄相关性黄斑变性(dAMD)C3降解剂药物CB2782-PEG的合作协议,将CB2782-PEG的权利归还给Catalyst Biosciences。在临床前研究中,CB 2782-PEG(125μg)单次注射28天后,可使非人灵长类动物的C3清除率超过99%。渤健此前以8亿美元收购Nightstar并获得两款针对视网膜适应症的基因疗法,但这两款疗法后期试验均遭遇严重挫折。
医药热点
1.浙江引导“两慢病”患者分级诊疗。浙江省卫健委印发《关于全面实施加强高血压糖尿病全周期健康管理推进分级诊疗改革的通知》,明确通过医保支付、财政补偿等政策支持,以上下联动、医防融合为突破口,引导高血压糖尿病患者在基层就诊、规范管理,构建连续、协同和有序的分级诊疗格局。力争至2022年年底,“两慢病”患者签约率达到80%以上,基层就诊率达到70%以上。
2.中药材生产质量管理规范发布。近日,国家药监局、农业农村部、国家林草局、国家中医药局发布《中药材生产质量管理规范》,对中药材生产的质量管理、种子种苗或其他繁殖材料、基地选址、种植与养殖等方面进行了明确规定,旨在推进中药材规范化生产。《规范》提出,鼓励企业开展中药材优良品种选育,禁用人工干预产生的多倍体或者单倍体品种、种间杂交品种和转基因品种。
3.强生高管2021年薪酬最高2674万美元。强生日前发布了公司高管2021年的薪酬报告。首席执行官(CEO)Alex Gorsky 去年总薪酬为2674万美元,同比2021年下降9.6%。这主要是因为其养老金显著下降,由643.6万美元降至70.3万美元。执行副总裁(EVP)兼首席财务官(CFO)Joseph Wolk在2021年收入1095万美元;首席科学官(CSO)Paulus Stoffels收入1500万美元;执行副总裁兼全球制药主席Jennifer Taubert收入1022万美元。
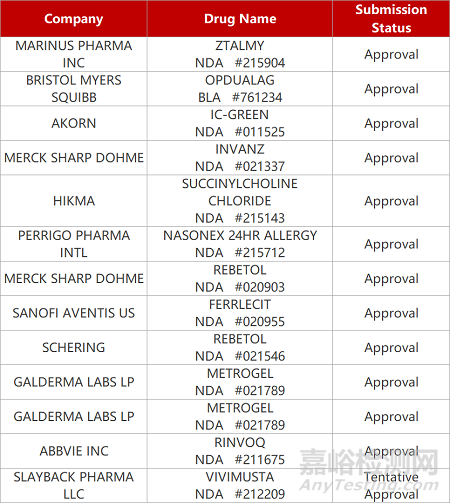
评审动态

来源:药研发