您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-21 13:52
创伤封闭的需求量极大,而缝合是创伤封闭的金标准,每年有数以万计的外科手术在闭合伤口。然而缝合并不是万能的,其操作繁琐,且缝合穿刺对组织带来的二次伤害可能会诱发感染或者造成渗漏,尤其是类似胃、肠、膀胱等具有贮藏功能的软组织。因此,我们希望寻求更好的创伤封闭方法来代替缝合。
由于很多内脏组织具有管腔结构,因此相对于流动态的组织胶水,胶贴形式存在的湿面粘附膜更适合修补他们的缺损。现有的研究为了达到伤口封闭的力学需求,使用的大多是降解速度较慢的合成材料。这些材料如果在体内长期存在会产生排异反应,只能起到伤口封闭作用而无法促进再生。因此,如何使用生物相容性高的材料达到快速、牢固的组织粘附效果,实现创伤封闭的同时促进再生仍是亟需解决的技术难题。
在此背景下,浙江大学基础医学院欧阳宏伟教授课题组基于在湿面组织粘附领域的研究积累,首次设计出基于完全可代谢的多聚氨基酸材料的免缝合光控自粘复软组织创伤修复膜(LAP),满足了免缝合修复所需的湿面粘附、抗拉和生物相容性的要求。此研究于近期在学术期刊Advanced Science上发表,题为“Polyglutamic Acid-Based Elastic and Tough Adhesive Patch Promotes Tissue Regeneration through In Situ Macrophage Modulation”。
LAP由可粘附水凝胶基质层和抗拉连底膜层构成。水凝胶基质主体材料选用能够降低排异反应的聚氨基酸材料——聚谷氨酸,基质表面修饰了实验室前期验证过的光敏小分子基团NB作为粘附基团。NB基团能够响应紫外光发生结构改变产生醛基,进而与组织上的氨基发生反应实现粘附。
而增强力学性能方面,研究团队首次提出复合膜结构的概念,引入可吸收PLLA薄膜作为底膜层提高力学性能。LAP紫外光照激活后,接触湿面组织能够快速吸收界面上的水分,使粘附基团与组织表面氨基密切接触发生反应,只需要在创面简单的按压即可实现创伤封闭。同时,LAP具有优秀的生物安全性和生物可降解性能,能够原位招募M2型巨噬细胞,创造有利于组织再生的免疫微环境,从而促进组织再生(图1)。
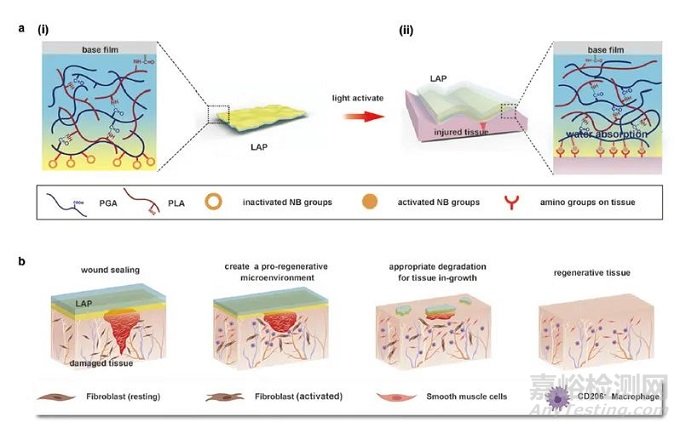
▲ 图1 LAP的创伤封闭和修复机制示意图
在多个离体组织上的模拟测试证明了LAP能够实现多种内脏组织创伤的粘附和封闭(图2)。
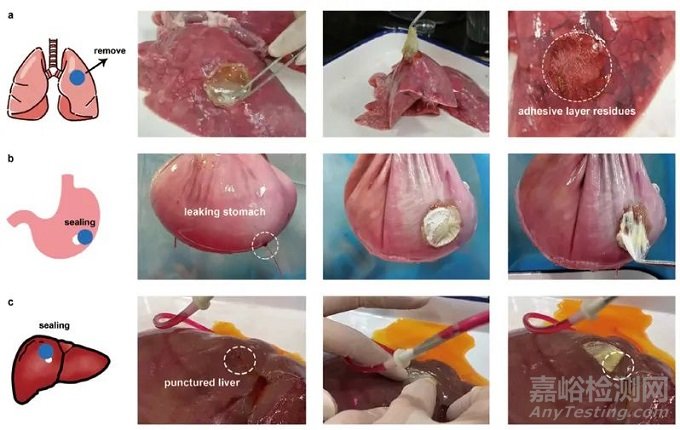
▲ 图2 LAP对多个软组织的粘附和创伤封闭
此外,研究人员通过皮下埋植的方法对LAP的生物安全性和原位巨噬细胞调控能力进行了探索。在术后1-2周内,埋植LAP的组织周边出现了显著的M2型巨噬细胞的聚集,而埋植医用胶水“氰基丙烯酸酯”的组织周边则出现了M0和M1型巨噬细胞的大量聚集。这一结果证明了LAP及其代谢产物具有良好的生物安全性,并且能够创造出适合组织再生的免疫微环境(图3)。
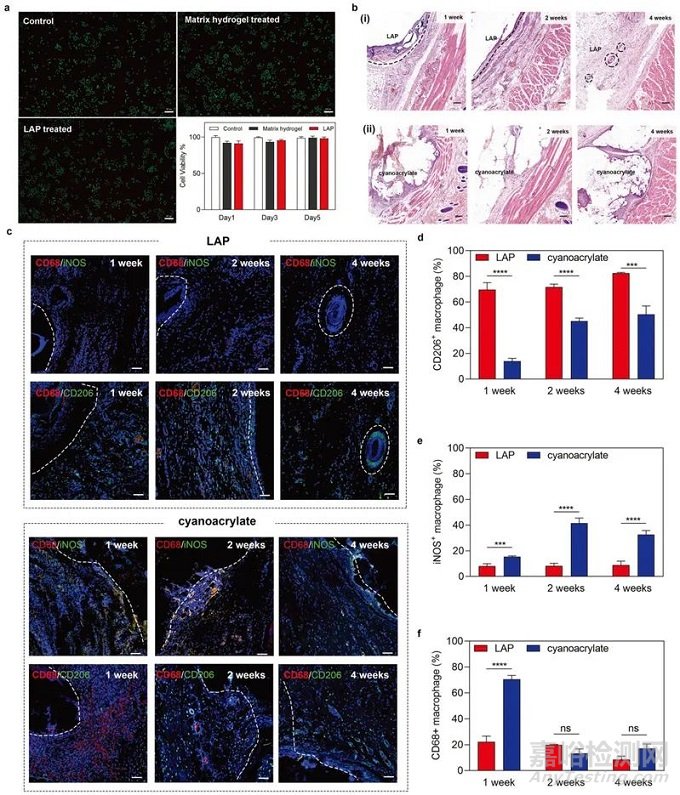
▲ 图3 LAP的生物相容性和巨噬细胞调控性能研究
最后,研究人员在新西兰大白兔的胃穿孔模型上对LAP的组织修复能力进行了验证。术后两周进行收样观察,施用了LAP的胃部无赘生物形成、伤口完全闭合。组织学切片染色证明LAP实现了胃组织的全层功能性修复,规避了传统缝合带来的二次创伤,克服了采用了生物安全性差的合成材料进行伤口封闭所造成的“封而不修”的缺点(图4)。
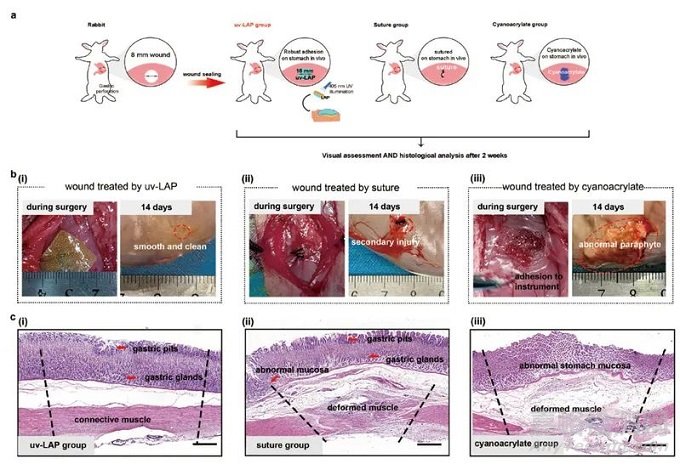
▲图4 LAP对兔胃穿刺伤口的封闭和修复
综上所述,该研究发明了一种基于聚谷氨酸的免缝合光控自粘复软组织创伤修复膜。它不仅具有优秀的机械性能,同时能够创造适合组织再生的免疫微环境。这种同时兼具了机械性能和免疫调控性能的特性,使其具有临床转化的应用前景。
浙江大学基础医学院2020级博士生朱秋文为本文的第一作者,特聘副研究员洪逸为共同一作,通讯作者为浙江大学基础医学院欧阳宏伟教授和浙江大学医学院附属第一医院邹晓晖教授。本研究得到国家重点研发计划(2017YFA0104900)和国家自然科学基金(NO. T2121004, 31830029, 92049117, 32171346)的支持。

来源:浙江大学


