您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-03-24 08:58
1. 实验原理
1.1 高脂饮食诱导代谢紊乱的模型基础
C57BL/6小鼠对高脂饮食(HFD)高度敏感,长期摄入高脂肪可诱导:
脂代谢紊乱:肝脏脂质合成(SREBP1c/FAS通路)增强,脂肪酸氧化(PPARα/CPT1通路)抑制,导致血清TG、LDLC升高,HDLC降低。
胰岛素抵抗:脂肪组织炎症(TNFα、IL6↑)干扰胰岛素信号传导,引发血糖调控异常。
氧化应激:过量游离脂肪酸促进活性氧(ROS)生成,导致肝脏MDA积累,SOD、GSHPx活性下降。
1.2 实验设计的科学依据
剂量选择:50-200 mg/kg/d参考人类膳食DHA推荐量(250-500 mg/d)及文献有效剂量。
阳性对照(鱼油):验证裂殖壶藻DHA与传统来源的效果差异,排除其他脂肪酸干扰。
检测指标关联性:
肝脏脂质含量与病理:直接反映DHA对脂沉积的改善效果。
AMPK/PPARα通路:关键靶点验证DHA的分子作用机制。
1.3技术路线
高脂饮食 → 脂代谢失衡 + 炎症/氧化应激 → DHA干预 → 激活脂氧化/抑制脂合成 + 抗炎抗氧化 → 改善血脂谱、减轻肝脏损伤。
1.4 实验目的
明确裂殖壶藻藻油中DHA对高脂饮食诱导的C57BL/6小鼠脂代谢紊乱的改善作用。
揭示DHA通过调控肝脏脂质合成、氧化及炎症通路改善代谢综合征的潜在机制。
1.5 灌胃
灌胃是动物实验中精确控制给药剂量和时间的常用方法,尤其适用于肥胖小鼠模型的长期干预研究。通过灌胃给予稀释后的DHA裂壶藻油等实验药物,可避免试验饲料摄入不均导致的剂量偏差,并直接观察药物对代谢指标(如血脂、血糖)的调控作用。
2. 实验材料
耗材:1 mL无菌注射器、钝头不锈钢灌胃针(20–22 g,长度3-4 cm)、无菌EP管、离心管
试剂:DHA裂壶藻油(含0.1%维生素E抗氧化剂)、橄榄油
设备:电子天平(精度0.1 mg)、微量移液器(10–1000 μL) 、小鼠固定器(或自制固定装置)
动物: C57BL/6 SPF级小鼠 4-6周龄
实验周期:建模九周,以高脂模型组小鼠均体重超过对照组均体重的15%-20% 视为肥胖小鼠模型建模成功,然后开始灌胃给药干预十周
3. 实验步骤
3.1 实验动物组别设计思路
3.1.1 核心组别设计原则
对照全面性:覆盖正常状态、疾病模型、干预效果及潜在干扰因素。
逻辑递进性:从基础对照到干预梯度,明确因果链条。
科学严谨性:排除非目标变量(如溶剂、操作应激)干扰。
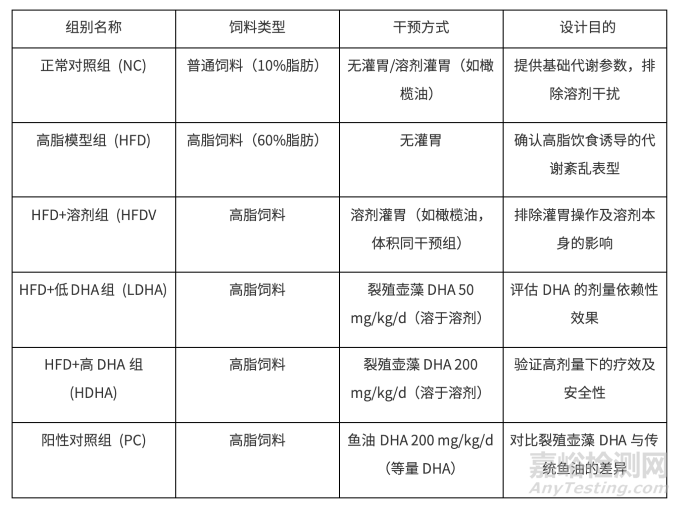
3.1.2 具体分组方案(每组8-10只)
3. 1.3 分组逻辑
NC vs HFD:验证高脂饮食是否成功诱导代谢紊乱(肥胖、高血脂等)。
HFD vs HFDV:排除溶剂(如橄榄油)对结果的影响(若溶剂本身含脂肪酸)。
HFDV vs LDHA/HDHA:明确裂殖壶藻DHA的独立作用,区分剂量效应。
HDHA vs PC:对比藻源与鱼源DHA的生物等效性,排除其他脂肪酸干扰。
3.1.4 关键设计细节
溶剂选择:若裂殖壶藻藻油需稀释,优先使用与藻油兼容的中性溶剂(如橄榄油、羧甲基纤维素钠),避免引入活性成分。
剂量依据:
低剂量(50 mg/kg/d):模拟人类膳食补充剂量(约250-500 mg/60 kg成人)。
高剂量(200 mg/kg/d):参考文献中有效剂量阈值,验证超生理剂量效果。
阳性对照匹配:确保鱼油组DHA含量与HDHA组严格一致(通过HPLC定量)。
3.1.5. 排除干扰因素
操作对照:所有灌胃组统一操作频率与时间,避免昼夜节律干扰。
体重匹配:实验前根据体重分层随机分组,确保组间初始体重无差异。
盲法设计:实验人员对分组信息设盲,减少主观偏差。
3.2 药物配制
1. 移液器吸取5 mL的500 mg/kgDHA裂壶藻油加入到装有45mL橄榄油的EP管中,涡旋混匀,配置浓度为50 mg/mL浓度的DHA药物溶液,吸取20 mL的500 mg/mL DHA裂壶藻油药物溶液到30mL橄榄油的EP管中,配置200 mg/mL的DHA药物溶液。然后涡旋振荡1 min至溶液均一。
2. 配制后立即使用,或避光保存于4℃(不超过24 h)。
3.3 小鼠固定与灌胃操作
以下是关于小鼠灌胃操作的注意事项,针对裂殖壶藻藻油干预实验的特别说明:
1. 灌胃前准备
器材选择:
使用小鼠专用钝头灌胃针(规格:1.52 cm长,直径11.5 mm),避免尖锐针头损伤食道或胃黏膜。
灌胃体积一般不超过0.1 mL/10 g体重(如20 g小鼠单次≤0.2 mL),避免胃部过度扩张。
藻油制备:
藻油为黏稠液体,需用溶剂(如橄榄油)稀释至50mg/kg,200mg/kg确保均匀悬浮。
灌胃前充分混匀,避免有效成分(如DHA/EPA)沉淀导致剂量偏差。
2. 灌胃操作规范
小鼠固定:
抓取小鼠颈后皮肤,使其头部与身体呈直线,轻轻向后倾斜(约30°),便于灌胃针顺食道进入胃部。
避免过度压迫颈部导致窒息或应激反应。

进针深度控制:
根据小鼠体重调整进针深度(参考:每10 g体重进针3-4 cm)。
关键步骤:灌胃针进入口腔后,沿上颚缓慢滑入食道,若遇阻力或小鼠剧烈挣扎,立即退出重新操作,避免刺破食道或气管。

灌药速度:
缓慢匀速推注液体(约0.1 mL/s),防止反流或误吸入肺。
3. 灌胃后观察
不良反应监测:
灌胃后观察小鼠12 min,确认无呼吸困难、咳嗽(可能提示误入气管)或呕吐。
若出现异常(如窒息、出血),立即停止实验并联系兽医处理。
记录与调整:
记录每日实际灌胃体积、小鼠体重及状态,及时调整剂量(如体重变化超过10%需重新计算灌胃体积)。
4. 特殊注意事项
藻油特性:
裂殖壶藻藻油可能含高比例多不饱和脂肪酸(易氧化),建议现用现配,或分装后避光保存于-20℃。
若藻油需与饲料混合(如长期干预),需评估其热稳定性(避免高温灭菌破坏活性成分)。
实验一致性:
固定操作人员:由同一人完成灌胃操作,减少操作差异。
空腹灌胃:建议在每日固定时间(如上午9点)空腹灌胃,避免食物干扰吸收。
5. 进行3-5次模拟训练(使用小鼠或模型)后再开展正式实验。通过规范操作可最大限度减少实验误差和动物损伤,确保裂殖壶藻藻油干预结果的可靠性。如需进一步优化细节,可结合预实验结果调整!
3.4 灌胃后处理
1. 记录给药时间、剂量及小鼠状态(如活动度、粪便形态)。
2. 若出现腹泻,次日降低剂量20%或调整溶剂比例。
4 注意事项
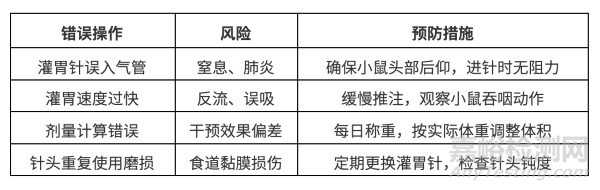
灌胃针选择:务必使用钝头针,尖锐针头易划伤消化道黏膜。
推注速度控制:过快易导致反流,建议每0.1 mL耗时3-5 s。
药物稳定性:DHA易氧化,需现配现用;若需储存,低温密封避光。
禁食处理:灌胃前禁食4 h(不禁水),减少呕吐风险。
抓取固定:右手拇指和食指捏住小鼠颈背部皮肤,掌心固定尾部,使小鼠呈仰卧位。
插入灌胃针:将灌胃针沿小鼠口腔右侧壁缓慢插入(约2–3 cm),遇阻力时轻退调整角度,避免损伤食道。
推注药物:匀速推注药液(0.1mL/10g体重),观察小鼠无呛咳后缓慢退出针头。
异常情况处理:
若小鼠剧烈挣扎,暂停操作并检查灌胃针位置。
灌胃后出现呼吸急促,可能误入气管,需立即停止实验并观察。
常见错误与预防:
5. 参考资料
[1] 裂壶藻DHA的抗氧化复配技术及稳定性研究
[2] C57BL/6小鼠高脂饮食诱导肥胖模型构建指南
[3] 动物实验灌胃操作规范(国家实验动物福利伦理委员会)

来源:实验老司机


