您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-07-10 01:12
摘 要 Abstract
近年来,受新冠肺炎疫情的影响,体外诊断试剂行业发展迅猛,同时也给监管工作带来了挑战。本文介绍了我国体外诊断试剂监管机构和相关法规文件,从体外诊断试剂的行业发展和监管现状、面临的新形势进行综述,对存在的问题进行分析,并提出解决问题的建议。以更好地了解发展规律,促进行业高质量发展、创新发展。
In recent years, under the impact of the COVID-19 epidemic, the industry of in vitro diagnostic reagents has developed rapidly, while bringing challenges to regulation. This paper introduces regulatory agencies in China for in vitro diagnostics and relevant regulations, summarizes industry development, supervision status and new trend, analyzes existing problems, and puts forward relevant solutions, in order to better understand and promote industry development and facilitate innovation.
关键词 Key words
体外诊断试剂;现状;新形势
IVD; current situation; new trend
体外诊断试剂,分为按医疗器械管理和按药品管理两类。按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品,可以单独使用,也可以与仪器、器具、设备或者系统组合使用。按药品管理的体外诊断试剂包括用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂[1]。本文主要对我国按医疗器械管理的体外诊断试剂近年来监管的现状及面临的新形势进行综述。
一、我国体外诊断试剂监管机构
我国体外诊断试剂监管机构包括国家和地方两个层级。国家药品监督管理局(以下简称国家药监局)主管全国体外诊断试剂注册与备案管理工作,负责建立体外诊断试剂注册与备案管理工作体系,依法组织境内第三类和进口第二类、第三类体外诊断试剂审评审批,进口第一类体外诊断试剂备案以及相关监督管理工作,对地方体外诊断试剂注册与备案工作进行监督指导。省、自治区、直辖市药品监管部门负责本行政区域内以下体外诊断试剂注册相关管理工作:①境内第二类体外诊断试剂注册审评审批;②境内第二类、第三类体外诊断试剂质量管理体系核查;③依法组织医疗器械临床试验机构以及临床试验的监督管理;④对设区的市级负责药品监督管理的部门境内第一类体外诊断试剂备案的监督指导。设区的市级负责药品监督管理的部门负责境内第一类体外诊断试剂产品备案管理工作[2]。监管方面,各级药品监管部门按照医疗器械分类分级监管规定分别落实属地监管责任,下面以国家级药品监管机构为例进行介绍。
1. 国家级药品监管机构及其内设机构
国家药监局是我国体外诊断试剂的行政管理机构,其中4 个司负责体外诊断试剂相关的监管工作。药品注册管理司主要负责按药品管理的体外诊断试剂上市前注册管理工作。药品监督管理司主要负责按药品管理的体外诊断试剂上市后监管工作。医疗器械注册管理司主要负责按医疗器械管理的体外诊断试剂注册管理工作。医疗器械监督管理司主要负责按医疗器械管理的体外诊断试剂上市后监管工作,负责组织指导实施体外诊断试剂监督检查、检验检测、不良事件监测等监管工作。
2. 国家级药品监管机构的直属技术机构
国家药监局直属专业技术机构依职责承担实施体外诊断试剂监督管理所需的体外诊断试剂标准管理、分类界定、检验、核查、监测与评价、制证送达以及相应的信息化建设与管理等相关工作。例如,中国食品药品检定研究院( 国家药监局医疗器械标准管理中心) 主要负责体外诊断试剂上市前注册和上市后监管相关的检验检测和标准制定。国家药典委员会主要负责按药品管理的体外诊断试剂的国家药品标准制定相关工作。国家药监局药品审评中心主要负责按药品管理的体外诊断试剂的临床试验、药品上市许可受理及技术审评等工作。国家药监局食品药品审核查验中心主要承担体外诊断试剂上市前注册和上市后监管相关的现场检查、有因检查和境外检查等工作。国家药监局药品评价中心( 国家药品不良反应监测中心) 主要承担体外诊断试剂不良事件监测与上市后安全性评价工作。国家药监局医疗器械技术审评中心负责境内第三类和进口第二类、三类体外诊断试剂产品注册申请、变更注册申请、延续注册申请等技术审评工作。
二、体外诊断试剂相关法规文件
1. 行政法规
2000 年1 月4 日,国务院发布《医疗器械监督管理条例》,并于2001 年4 月1 日开始实施,在我国医疗器械监管史上具有里程碑意义,标志着我国医疗器械监管真正迈上法制化管理的轨道。国务院分别于2014 年和2017 年对《医疗器械监督管理条例》进行了修订。为适应医疗器械监管和行业发展新形势需要,2020 年12 月21 日,国务院第119 次常务会议修订通过《医疗器械监督管理条例》[3],并于2021 年6 月1 日起施行。
2. 部门规章及规范性文件
为推动《医疗器械监督管理条例》的贯彻落实,国家药品监管部门共制定了13 部相关配套规章,形成以《医疗器械监督管理条例》为核心,相关配套规章和规范性文件为辅助的医疗器械全生命周期管理法规体系。部分规章阐述如下。
第一部分是体外诊断试剂说明书和标签管理、命名规则、标准管理、注册与备案管理等上市前监管6 部规章。《医疗器械说明书和标签管理规定》于2014 年10 月1 日起施行,规定医疗器械应当附有说明书和标签,要求医疗器械说明书和标签的内容应当科学、真实、完整、准确,并与产品特性相一致。《医疗器械通用名称命名规则》于2016年4 月1 日起施行,明确了通用名称命名应当遵循的原则、内容要求和组成结构、通用名称的禁止性内容。《医疗器械标准管理办法》于2017 年7月1 日起施行,明确了医疗器械标准的分类依据及种类,理顺了医疗器械标准体系。《体外诊断试剂注册与备案管理办法》于2021 年10 月1 日起施行,强化体外诊断试剂注册人、备案人主体责任落实,要求加强体外诊断试剂全生命周期质量管理,坚持落实“放管服”改革要求。因《体外诊断试剂注册与备案管理办法》《体外诊断试剂分类规则》已发布实施,《医疗器械注册与备案管理办法》《医疗器械分类规则》在此不作具体介绍。
第二部分是体外诊断试剂生产、经营、使用、网络销售监管以及飞行检查、不良事件监测与再评价、召回管理等上市后监管方面的7 部规章,如《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》《医疗器械使用质量监督管理办法》《医疗器械网络销售监督管理办法》《药品医疗器械飞行检查办法》《医疗器械不良事件监测和再评价管理办法》《医疗器械召回管理办法》。在医疗器械上市后各个环节形成有力的监管法规体系,倒逼企业落实主体责任,保障产品质量安全。
第三部分是与规章配套的规范性文件体系。主要包括标准和分类、注册和备案、指导原则、临床试验、检验检测、创新优先程序、生产经营许可备案、生产经营质量管理规范、企业分类分级监管、监督抽验、不良事件监测评价、产品召回等。2020 年以来,为了防范新冠肺炎疫情,国家药监局发布了一系列做好新冠病毒检测试剂质量监管和专项抽检及加强新冠病毒检测试剂注册与监管等方面的文件,全力确保抗原检测试剂安全,服务疫情防控大局。
三、我国体外诊断试剂监管现状及工作成效
1. 行业现状
根据IQVIA 报告预测,全球体外诊断试剂市场未来5 年的年均复合增长率(compound annual growth rate,CAGR)超过5%。其中,发达国家未来5 年的CAGR 在2% 左右,发展中国家未来5 年的CAGR 在9% 左右,中国未来5年的CAGR 预计将超过10%[4]。医疗器械产业是大健康产业中增长最为迅速的领域,已成为我国高新技术产业经济增长表现突出的重要产业之一[5]。2020 年以来,受新冠肺炎疫情影响,国际市场对我国医疗器械产品需求增加,我国生产的防疫物资大量出口,体外诊断试剂产品呈井喷式增长,产品出口成绩亮眼。根据中国医药保健品进出口商会统计,2020 年我国主要体外诊断试剂共出口50.87 亿美元,同比激增901.96%。其中,免疫试剂产品出口31.78 亿美元,同比增长率高达1540.84%,出口新冠病毒检测试剂10.8 亿人份,体外诊断试剂成为出口增长最显著的产品[6]。
2. 注册审批情况
2014~2019 年,医疗器械注册审批呈现一定波动,但2019 年后呈持续上升趋势(图1)。
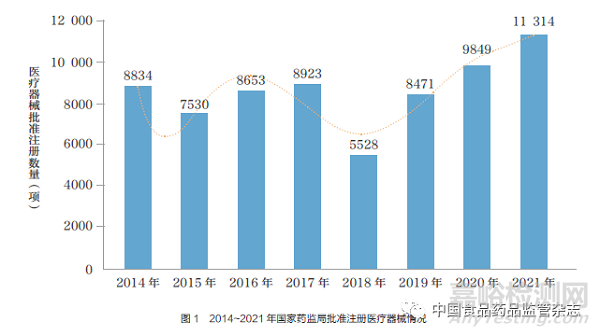
2021 年,国家药监局批准注册境内第三类医疗器械4596 项,与2020 年相比增加27.6%,批准注册进口医疗器械6718 项, 与2020 年相比增加7.6%。按照注册品种区分, 体外诊断试剂3470 项,占全部医疗器械注册数量的30.7%[7] 。
截至2021 年底,全国境内第一类医疗器械备案累计117 198 件;省级药监局共批准注册境内第二类医疗器械78 561 件。
3. 上市后监管工作成效
(1)医疗器械法制基础进一步夯实。全面实施新修订的《医疗器械监督管理条例》,积极开展条例宣贯培训。全力推进新发布的《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》的宣贯及配套规范性文件的制修订。
(2)防疫用械质量安全保障有力。常态化检查新冠病毒检测试剂生产企业,开展三轮全覆盖抽验,对新批准新冠病毒检测试剂生产企业全覆盖飞行检查,确保产品质量安全。组织各省(自治区、直辖市)开展新冠病毒检测试剂检验能力建设,生产企业所在省级药监局均具备检测能力。
(3)医疗器械风险治理成效显著。以防疫用械、集采产品、网售产品等九大类为重点,全面排查,着力消除区域性、系统性隐患。
(4)质量抽检靶向性逐渐增强。紧盯问题企业和产品,国家医疗器械质量抽检和省级抽检分工协作,互为补充。2021 年,国家医疗器械质量抽检63 个品种,新冠病毒检测试剂和集采中标支架专项抽检覆盖全部品种,抽检结果显示质量稳定。
(5)加强案件督办指导。从各地2018 年以来查办的案件中遴选典型案例,形成《医疗器械典型案例汇编手册(2021)》印发各地,指导医疗器械案件查办工作。
(6)国际交流合作持续深入。2021 年,国家药监局组织参与国际医疗器械监管者论坛(IMDRF)会议,我国牵头的“上市后临床随访研究”文件获批发布,并成功举办第十二届中国医疗器械监督管理国际会议(CIMDR)。
四、体外诊断试剂行业发展和监管面临的新形势及存在的问题
1. 竞争日趋激烈,但行业发展前景持续向好
从国际看,当前世界百年变局和世纪疫情交织,外部环境更趋复杂严峻和不确定,经济全球化遭遇逆流。我国高端医疗器械面临关键核心技术和关键原材料“卡脖子”的问题突出,医疗器械行业竞争日趋激烈。从国内看,我国经济发展面临需求收缩、供给冲击、预期转弱三重压力,经济下行压力较大,发展不平衡不充分持续显现。在关键核心技术、产业链供应安全稳定、创新产品推广应用等方面,我国医疗器械产业发展还存在一些不容忽视的短板弱项,产业结构和产业集中度仍需进一步优化,创新引领力、国际竞争力与世界一流水平还有较大差距。
但近年来,尤其是在抗击新冠肺炎疫情阶段,我国医疗器械产业蓬勃发展,产品研发投入、创新产品上市、企业增长、主营收入均呈上升趋势,《“十四五”医疗装备产业发展规划》[8] 提出:“到2025 年,医疗装备产业基础高级化、产业链现代化水平明显提升,主流医疗装备基本实现有效供给,高端医疗装备产品性能和质量水平明显提升,初步形成对公共卫生和医疗健康需求的全面支撑能力。”“到2035 年,医疗装备的研发、制造、应用提升至世界先进水平。我国进入医疗装备创新型国家前列,为保障人民全方位、全生命期健康服务提供有力支撑。”这也将形成巨大的市场预期,可以预见,“十四五”乃至更长时期,我国医疗器械产业发展前景将持续向好。
2. 能力建设迫在眉睫,监管工作任重道远
进入新时代新发展阶段,医疗器械监管形势正在发生深刻变化。与科技进步和产业发展相比,我们的监管力量和专业能力明显不足,职业化专业化医疗器械检查员、审评员队伍建设急需加快推进,健全监管体系、提升监管能力刻不容缓。当前,内外环境的不断变化,各种风险有可能叠加、联动、传导、共振,医疗器械质量安全监管将面临更为复杂的环境,确保医疗器械质量安全任务繁重、艰巨,任重而道远。
五、体外诊断试剂监管工作相关建议
1. 加快推进配套规章制度的修订完善
加大《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》的宣贯力度,一体推进与生产、经营监管等规范性文件的制修订和发布实施。
2. 加大医疗器械监管能力建设力度
全面实施《“十四五”国家药品安全及促进高质量发展规划》[9]。指导督促各地贯彻落实《关于全面加强药品监管能力建设的实施意见》[10],把握政策机遇,切实加强医疗器械监管能力建设。
3. 强化体外诊断试剂全生命周期监管
坚决落实企业主体责任,各地药品监管部门要加强对体外诊断试剂研发、生产、经营、使用各环节的监管,确保质量安全。首先要加大对体外诊断试剂生产企业的监督检查,要让生产企业在持续符合生产质量管理规范的基础上作业;其次要抓好流通使用环节监管,确保进入医疗临床使用的体外诊断试剂安全、有效。
4. 进一步完善体外诊断试剂相关标准
体外诊断试剂品种门类繁多,药品监管部门要加快制订完善体外诊断试剂国家标准,提升标准覆盖面。
5. 加强相关法规宣传和专业知识培训
鉴于体外诊断试剂品类多、专业性强,各级药品监管部门和卫生监管部门各自依职责定期组织监管人员、体外诊断试剂生产经营企业相关责任人、使用单位医疗机构有关科室人员进行体外诊断试剂相关业务培训,全力保障体外诊断试剂安全生产、有序流通、规范管理、质量安全有效。

来源:中国食品药品监管杂志


