您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2022-08-24 19:28
根据FDA的唯一医疗器械标识符(UDI)规则,大多数医疗器械的标签和包装必须包含UDI。产品的品牌持有人必须申请UDI并且将产品信息,包括产品识别码(DI),产品代码,以及其他特征上传至全球唯一器械识别码数据库(GUDID)。
2022年7月25日,FDA官网又更新了:《Unique Device Identification: Policy Regarding Compliance Dates for Class I and Unclassified Devices, Direct Marking, and Global Unique Device Identification Database Requirements for Certain Devices》。FDA再次更新该指南文件,足以见得FDA在美国推行唯一医疗器械标识码(UDI)的重视程度。FDA拥有世界范围内最强大的数据,UDI有关的GUDID数据库也是其极其重要的模块之一。
今天我们就一起来看一下FDA唯一医疗器械标识UDI该如何建立?
UDI是什么?
Unique device identification (UDI) 是美国食品药物管理局FDA建立的“特殊医疗器械的识别系统”,该注册码的实施是为了有效识别在美国市场上销售并使用的医疗器械,无论这个器械的生产地所属哪里。UDI一旦实施,NHRIC和NDC标签将废止,所有的医疗器械都需要将这个新的注册码作为标识贴在产品的外包装上。UDI是一串识别某个医疗器械品牌持有人的某个医疗器械的人眼及机器可读的编码。括号中的数字限定了后面跟随的数字或者字母与数字结合的代码的具体指代意义。
UDI由两个主要元素组成:
器械标识 (Device Identifier (DI))
生产标识 (Production identifier (PI))
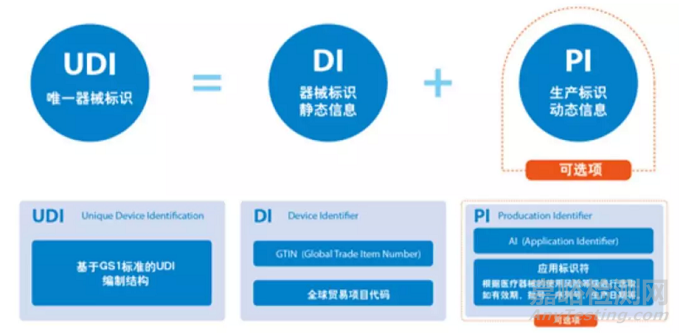
1)DI定义了产品的品牌持有人以及产品的版本或者型号。在FDA的GUDID数据库中,DI被作为关键信息用来标识并追溯到规格型号的某一器械唯一编码。
2)PI定义器械的生产信息包括:生产日期、失效日期、生产批号和序列号。
UDI申请步骤
1)企业需要为每一个产品确定UDI合规期限;
根据医疗器械的分类,FDA的UDI合规期限跨度达六年之久。
2)申请并获得DUNS号码;
所有的医疗器械品牌持有人必须要申请一个数据通用编号系统(DUNS)号码,该号码相当于企业的“身份证”,是用于在GUDID数据库中识别品牌持有人的有效编码。符合UDI要求的医疗器械品牌持有人必须有DUNS号码。
3)指定法规联络人;
FDA要求医疗器械品牌持有人指定一个联系人负责联络。法规联络人需确保相关的UDI通过GUDID递交给FDA。
4)识别GMDN码;
品牌持有人必须为提交给GUDID的每个医疗器械确定一个全球医疗设备命名(GMDN)首选术语代码。我司建议企业下申请UDI前就为医疗器械申请好GMDN代码,因为申请周期可能会很长。
5)集合贵司的UDI;
UDI码由器材标志(DI)和生产制造标志(PI)构成。DI务必由FDA受权的发售组织分派。目前有三家认可签发机构可供选择:新泽西州的GS1,亚利桑那州的HIBCC,和加利福尼亚州的ICCBBA。PI则由生产制造信息内容来明确,例如生产制造批号或生产批号。每一个器材的不一样版本号或是型号规格都务必要各自申请办理UDI。选择一个PI 除I类医疗器械外,所有医疗器械的UDI必须包含一个生产标识符(PI)。PI则由生产制造信息内容来明确,例如生产制造批号或生产批号、序列号、有效期、生产日期。
6)建立一个GUDID账户并提交产品信息。
品牌持有人在确定好如何向GUDID提交数据后,他们应该创建适当的GUDID账户。FDA鼓励那些选择通过web界面提交的人通过创建递交草样来熟悉系统。企业需要汇总产品信息并且递交到GUDID数据库并收集关于每个医疗器械的各种信息,包括医疗器械的描述、DI码、品牌名称、版本号或型号、GMDN代码、FDA产品列名号等等。
应该申请多少个UDI?
一个类型的医疗器械的不同规格需要分别申请UDI,包括不同尺寸,不同颜色,不同材料,不同款式,不同包装等等。
例如:一个公司生产手术衣:每种手术衣有S、M、L三种尺寸、每种尺寸有蓝色和白色两种颜色、手术衣分有口袋和无口袋两种款式、每种手术衣有50件一包和100件一包,即3种尺寸x 2种颜色x 2种款式x 2种包装,那么手术衣总共需要申请24个UDI码。

来源:德大器械产业管家


