您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-02 11:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.安斯泰来JAK3抑制剂在华报产。安斯泰来5.1类进口新药吡西替尼(peficitinib)治疗类风湿性关节炎的上市申请获CDE受理。吡西替尼是安斯泰来自主研发的一款选择性JAK3抑制剂,已于2019年3月在日本获批上市,用于治疗对常规疗法反应不足的类风湿性关节炎(包括预防结构性关节损伤)患者。全球目前仅有3款用于治疗类风湿关节炎的JAK抑制剂上市,分别为辉瑞托法替布、礼来/Incyte baricitinib以及安斯泰来的peficitinib。
2.海思科环泊酚美国III期临床成功。海思科短效GABAA受体调节剂环泊酚注射液在美国开展的用于择期手术中全身麻醉诱导的III期临床(HSK3486-304)获得积极初步结果。该项试验达到非劣效性标准,环泊酚的麻醉诱导成功率和丙泊酚相当。此外,环泊酚注射痛发生率显著低于丙泊酚,两组中重度(NRS 评分≥4)注射痛发生率分别为6.0%和61.4%。海思科正积极推进该新药第二项美国III期临床试验。
3.第一三共HER3 ADC新药国内启动III期临床。第一三共HER3 ADC新药Patritumab deruxtecan(U3-1402)在中国登记启动一项III期临床,拟在携带EGFR激活突变(外显子19缺失或 L858R)的转移性或局部晚期非鳞状非小细胞肺癌患者中比较Patritumab deruxtecan与含铂化疗的有效性。这是国际HERTHENA–Lung02研究的中国部分,试验由吴一龙教授牵头。此前,这款“first-in-class”新药已获FDA授予突破性疗法认定,用于EGFR耐药的非小细胞肺癌经治患者。
4.康方PD-1/VEGF双抗拟纳入突破性治疗品种。康方生物自主研发的PD-1/VEGF双抗AK112(依沃西单抗)获CDE拟纳入突破性治疗品种,用于一线治疗PD-L1表达阳性(TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)。AK112可阻断PD-1与PD-L1和PD-L2的结合,并同时阻断VEGF与VEGF受体的结合,具有协同抗肿瘤的潜力。目前,康方生物正在两项Ⅲ期临床中,评估AK112联合化疗治疗EGFR-TKI耐药的EGFR突变的晚期非鳞状NSCLC,以及AK112用于一线治疗PD-L1阳性的NSCLC的效果。
5.邦耀Quikin CAR-T成果见刊Nature。上海邦耀生物与华东师大、浙大医学院附一院合作的非病毒定点整合CAR-T技术(Quikin CART®)研究成果发表在期刊Nature上。Quikin CART®技术可在不使用病毒载体的情况下,通过一步制备获得基因组定点整合的CAR-T细胞产品。2020年5月,在浙大医学院附一院开展的全球首个"PD1敲除非病毒定点整合CD19-CART细胞治疗复发难治性非霍奇金淋巴瘤的临床试验"中,该产品显示出良好的安全性和初步疗效,首例患者疾病完全缓解(CR)超过2年。
国际药讯
1.诺华白血病新药获欧盟批准上市。欧盟委员会批准诺华制药STAMP抑制剂Scemblix®(asciminib)上市,用于治疗先前使用过两种或多种酪氨酸激酶抑制剂治疗的慢性期费城染色体阳性慢性髓细胞白血病成年患者 。一项III期ASCEMBL研究结果显示,与博舒替尼组相比,Scemblix治疗组患者主要分子学反应(MMR)率更高(25.5%vs13.2%),因不良反应导致的停药率降低三倍以上。
2.两款新冠二价疫苗获批EUA。FDA批准Moderna、辉瑞/BioNTech针对Omicron BA.4/BA.5的二价新冠mRNA疫苗的紧急使用授权(EUAs)申请,授权这两款二价疫苗作为单剂加强针,在基础免疫或加强免疫至少两个月后使用。其中,Moderna的二价新冠mRNA疫苗mRNA-1273.222被授权用于18岁及以上成人;辉瑞/BioNTech的二价新冠mRNA疫苗被授权用于12岁及以上成人。目前,Omicron BA.4/5是美国流行的主要变异株。
3.赛诺菲创新酶替代疗法获FDA批准上市。FDA批准赛诺菲旗下Genzyme公司的创新酶替代疗法Xenpozyme(olipudase alfa)上市,用于静脉输注治疗酸性鞘磷脂酶缺乏症(ASMD)的成人和儿童患者。Xenpozyme是一款酸性鞘磷脂酶重组蛋白,旨在分解鞘磷脂避免鞘磷脂积累造成肺、脾、肝等器官损害。今年3月和6月,该新药已分别在日本和欧盟获批,是首款获批用于ASMD患者非中枢神经系统症状的治疗药物。
4.Denali脑渗透酶替代疗法上Ⅱ/Ⅲ期临床。Denali公司开发的可穿越血脑屏障的酶替代疗法DNL310,在治疗II型黏多糖贮积症(MPS II)的Ⅰ/Ⅱ期临床新的中期分析结果积极。所有患者24周时脑脊液(CSF)内硫酸乙酰肝素水平较基线下降89%,接近正常值,并维持至49周;神经节苷脂(ganglioside)GM2与GM3的平均下降水平分别为63%与52%。在给药长达一年时,大多数患者的总体MPS II症状、认知能力和行为较基线均出现临床改善。药物的安全性特征与标准治疗保持一致。Denali拟启动Ⅱ/Ⅲ期临床COMPASS试验。
5.不含药便秘疗法获FDA批准上市。Vibrant Gastro公司创新口服胶囊Vibrant获FDA批准上市,用于治疗慢性特发性便秘患者。这是一款基于体外编程控制、不包含任何药物的一次性胶囊疗法,它通过对肠道进行机械刺激来调节人体的生物钟,恢复自然的排便生物节律。在关键临床中,与安慰剂相比,该疗法使患者每周达到一次或多次CSBM(完全自发排便)的比例更高(39.26%vs22.15%),每周达到两次或更多CSBM的比例也更高。
6.PD-1联合ICOS激动剂肺癌II期研究失败。Jounce公司ICOS激动剂vopratelimab (vopra)联合PD-1抑制剂pimivalimab(pimi)对比pimivalimab二线治疗非小细胞肺癌(NSCLC)的II期SELECT试验未达主要终点。结果显示,pimivalimab单药组患者肿瘤体积较基线增长7.33%,联合治疗组增加0.23%,两组间的差异为7.1%,未达到主要终点。不过vopra低剂量组(0.03mg/kg)肿瘤体积缩小7.89%,在主要终点和次要终点方面都观察到有利的趋势。vopra总体耐受性良好。
医药热点
1.福建省检验医学专科联盟成立。国家区域医疗中心福建省检验医学专科联盟8月25日正式成立。该联盟由福建医科大学附属第一医院,华山医院福建医院牵头成立,共有133家成员单位。联盟将以国家区域医疗中心为基点,以专科技术力量为支撑,促进联盟单位检验医学在医、教、研各方面协同发展、共同进步,提升整体检验医学水平。
评审动态
2. FDA新药获批情况(北美08月31日)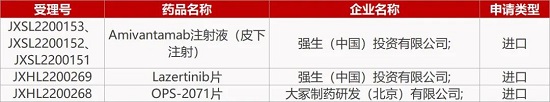
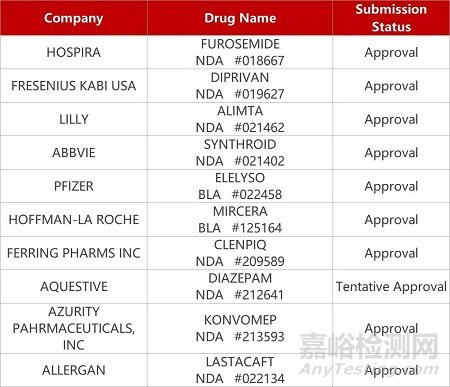

来源:药研发


