您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-21 23:50
前言
输尿管狭窄可由输尿管损伤、放疗、输尿管结石、尿路感染和输尿管子宫内膜异位症引起,通常需要进行输尿管重建。虽然组织工程、自体组织移植和应用各种皮瓣的手术技术已经被用于输尿管再生,且都取得了一定的成功,但每种方法都各有其优缺点。
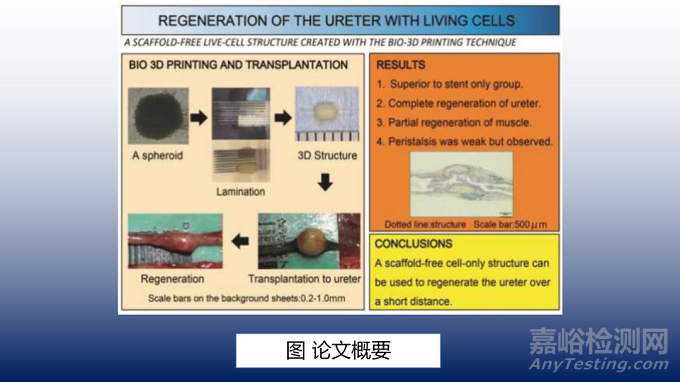
近日来自日本长崎大学的Katsunori Takagi团队在《Acta Biomaterialia》杂志发表了Regeneration of the ureter using a scaffold-free live-cell structure created with the bio-three-dimensional printing technique一文,探索了输尿管再生的新方法。
一、背景
急性输尿管损伤占术中损伤的80%(其余20%是外伤所致),可引起瘘管形成和肾盂积水,导致输尿管狭窄。放射治疗、输尿管结石、尿路感染和输尿管子宫内膜异位症也可引起这种输尿管狭窄。另外,儿童可能会患有先天性输尿管狭窄、先天性输尿管梗阻和其他需要输尿管重建的疾病。
目前,使用可生物降解的聚合物通过组织工程进行输尿管再生是最先进的尿路和输尿管重建技术。尽管使用具有高生物相容性的材料已经取得了一些结果,但可能出现肾盂积水和移植物感染等并发症,因此这种方法尚未在临床上应用。
自体静脉移植也取得了良好的效果。由于这种技术使用自体组织,不需要担忧免疫抑制问题,唯一的缺点是需要从正常部位提取移植物。然而,使用这种方法是否有可能进行长节段重建尚不清楚。因此,尚未在临床上应用。
虽然临床上最可靠的方法是输尿管部分切除和端到端吻合,但随着切除输尿管尺寸的增加,需要手术重建,如使用回肠导管或膀胱壁的Boari皮瓣手术。然而,使用回肠导管需要肠切除和尿路改变,具有高侵入性,且并发症发生率高。而使用膀胱壁需要先进的外科手术,很少有外科医生能够完成。
因此,需要探索替代上述手术方法的方法。研究团队之前已经使用无支架的细胞结构再生了管腔器官,如气管和食道,并取得了良好的效果。在本研究中,研究团队试图使用仅由活细胞组成的人工输尿管来再生活大鼠的输尿管。
二、材料制备
1. 细胞培养
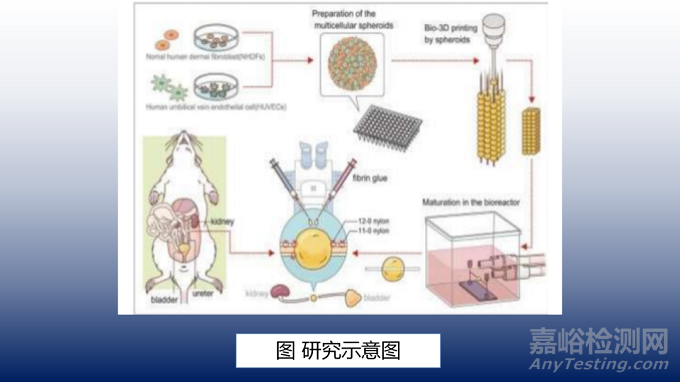
本研究采用正常的人皮肤成纤维细胞(NHDFs)和人脐静脉内皮细胞(HUVECs)。将人皮肤成纤维细胞置于DMEM培养基和Ham’s F-12 培养基中培养,加入胎牛血清素和100U/mL链霉素-两性霉素B。将人脐静脉内皮细胞置于内皮细胞生长培养基2(EGM-2)中培养,加入人表皮生长因子、血管内皮生长因子、R3胰岛素样生长因子1、抗坏血酸、氢化可的松、人成纤维细胞生长因子碱性、肝素、胎牛血清和庆大霉素-两性霉素-B。
2. 球状体产生
将由90%NHDFs和10%HUVECs组成的3.5×106个细胞每毫升的悬浊液加入到超低吸附的圆形96孔板上,每个孔中加入100微升。将孔板置于37摄氏度的加湿环境下培养,环境二氧化碳浓度约为5%。72小时后,细胞形成500-700微米大小的球体。
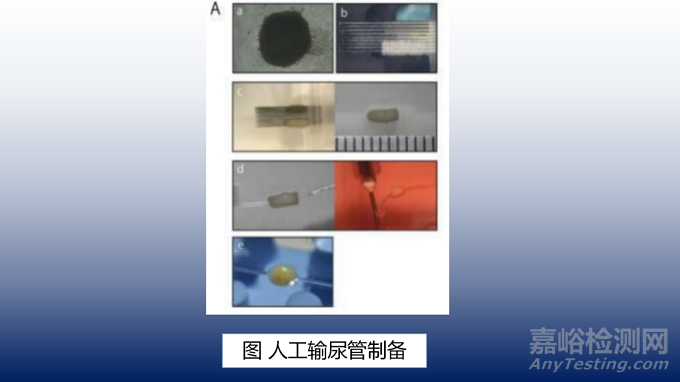
3. 人工输尿管的构建
人工输尿管结构设计与连接正常大鼠输尿管的吻合口相吻合,小轴为0.7-0.9mm。总共有12层球状体堆叠在一个3×3微针阵列(称为Kenzan)主轴约为7mm,直径约为1.5mm。使用RegenovaBio-3D打印机将球状体层压成这个人工输尿管结构,并使用“Kenzan方法”将细胞串到微针阵列上。然后,将该结构放置在一个装有等量成分的DMEM/Ham’sF12和EGM-2的生物反应器中培养一周。随后,从 Kenzan支架上取出人工结构,在显微镜下将一个外径为0.3mm、内径为0.2mm的硅支架插入其中心。为了促进球状体之间的融合并增加它们的强度,将插入硅支架的结构在循环培养中返回到生物反应器中,再进行7周或更长的时间培育。
三、实验部分
本研究使用了13只雄性F344大鼠,每只体重260-400g。大鼠随机分为5组:2周安乐死组(n=3)、4周安乐死组(n=3)、8周安乐死组(n=3)、12周安乐死组(n=1)和硅胶支架组(n=3)。
给大鼠吸入异氟醚进行麻醉,然后肌肉注射剂量为100mg/kg的氯胺酮。在腹部中线切口,露出左侧输尿管。显微镜下解剖输尿管。输尿管残端肾侧和膀胱侧之间的距离约为2mm。然后,将带有硅支架的人工输尿管结构插入输尿管肾和膀胱两侧约5mm,用尼龙线缝合输尿管两端并固定在输尿管壁上。人工输尿管在循环过程中收缩成约2毫米的球形结构。将人工结构和正常大鼠输尿管吻合。为了加强移植的结构,在其周围滴两滴纤维蛋白胶,然后封闭腹膜,缝合腹壁完成手术。
移植完成后,大鼠皮下注射他克莫司(0.5mg/kg),每天应用这种免疫抑制治疗,直到实验结束。
四、实验分析
1. 宏观与组织病理学分析
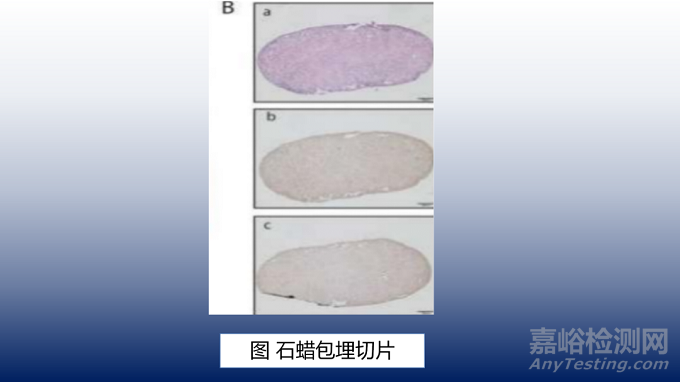
在移植前对人工输尿管结构进行了组织病理学评估。这些结构用甲醛固定,并用石蜡包埋。石蜡包埋组织的超薄切片用苏木精和伊红、抗泛细胞角蛋白和抗VEGFA染色(如图4B)。并记录在移植过程中,人工输尿管的形态变化。
分别在人工输尿管移植后2、4、8、12周处死大鼠,并进行宏观和组织病理学评估。首先,观察采用人工输尿管结构移植的输尿管,并记录其蠕动状态。接下来,在移植结构的膀胱侧进行解剖,确认是否有尿流出。取出移植部分及两侧的正常输尿管,切除移植部分。最后,取左右肾,从中间剖开,根据胎儿泌尿学学会分级评估肾积水程度。
在评估每个项目后,将移植的结构、正常输尿管和左右肾用甲醛固定,并用石蜡包埋。石蜡包埋组织的超薄切片分别用苏木精和伊红以及抗尿苷、抗泛细胞角蛋白、抗平滑肌肌动蛋白、抗VEGFA和抗细胞角蛋白-14染色,分别用于组织病理学和免疫组化分析。另外,对移植的结构进行Masson三色染色。
2. 统计学分析
研究团队比较了人工输尿管结构组(n=10)和仅使用支架治疗组(n=3)的整体肾积水程度。此外,测量了输尿管的直径,以比较健康输尿管(n=5)和再生输尿管(n=4)的横截面积,以估计尿流量。使用JMPPro软件对数据进行分析,比较采用非配对t检验和Welch的t检验。
五、结论
1. 宏观分析
所有大鼠在移植后体重均有所下降,在本实验的12周的过程中,没有实验鼠死亡。移植时,人工输尿管结构呈球形(如图5 A,E,I,M)。在动物死亡时,人工输尿管已经粘附在周围的组织上。因此,这些结构的周边需要被小心地剥离。在移植时,第2、4、8、12周时的人工输尿管结构均小于移植时(如图5B,F,J,N)。
移植输尿管侧的肾脏几乎与未接触输尿管的一侧的健康肾脏大小相同(如图5C,G,K,O)。在第4周处死的大鼠中,双肾切面显示肾盂轻微扩张,对应于肾盂1级积水(如图5H).然而,在第2、8和12周处死的动物中,没有观察到肾球膜的扩张,对应于0级(如图5D,L,P)。移植侧肾与健康侧肾肾皮质和髓质厚度无差异,输尿管移植后肾形态无明显异常。在周围输尿管剥离时观察到尿流出,证实尿可通过人工输尿管结构,无问题。虽然所有大鼠均观察到输尿管蠕动,但比正常输尿管蠕动弱。大鼠在第12周表现出最强的蠕动。
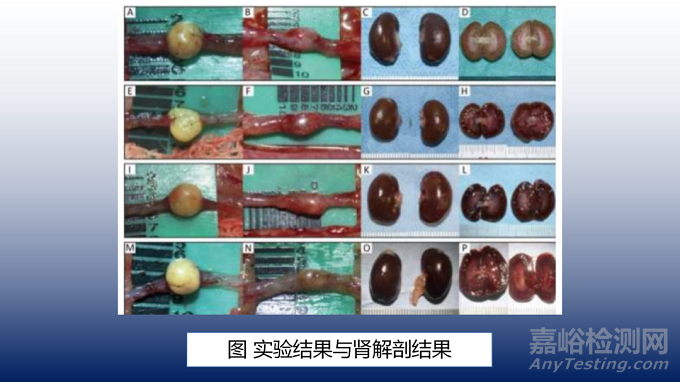
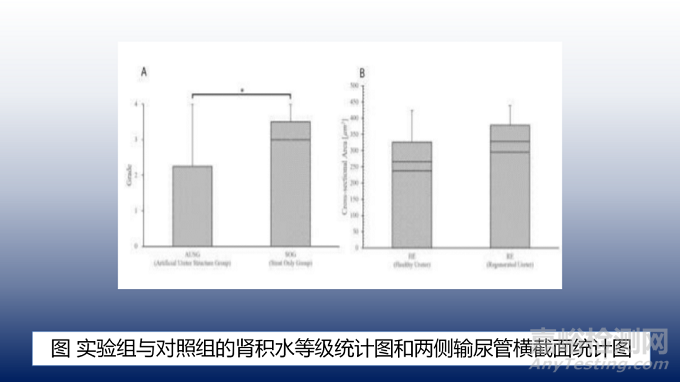
仅使用支架组所有大鼠均表现为3-4级严重肾积水和输尿管膨出。相比之下,70%的人工输尿管结构组表现为0-1级肾盂积水。人工输尿管结构组肾积水分级为1.00±2.66和仅使用支架组为3.33±0.33。仅使用支架组的肾积水分级明显高于实验组(如图6A)。
2. 组织病理学分析
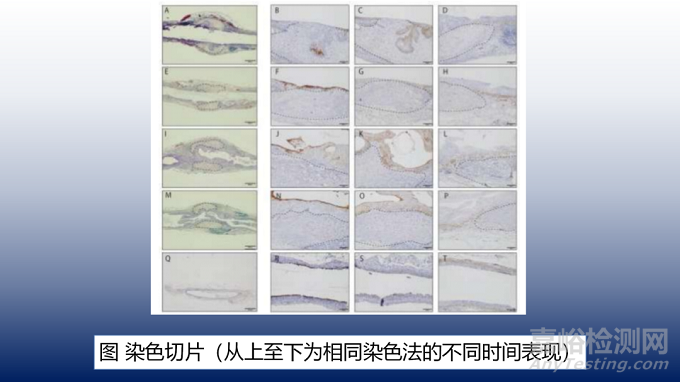
人工输尿管结构与受体输尿管融合,无任何间隙。在第2周,在人工结构内观察到上皮细胞内陷。很可能在移植时,尿液侵入了支架的插入位置,并继续在管腔内再生上皮细胞(如图7A,E,I,M)。
免疫组化分析显示,第2周大鼠人工输尿管管腔内有抗尿素抗体染色,输尿管上皮未见完全再生(如图7B)。然而,4周后,所有大鼠的尿路管腔都被无缝染色(如图7F,J,N)。通过抗泛细胞角蛋白抗体染色,观察到第2周大鼠人工输尿管结构的管腔内的细胞是单层的(如图7C),但在第4周大鼠中形成了2-3层(如图7G)。在第8-12周的大鼠中,厚度最终达到4-5层(如图7K,O)。抗αSMA抗体染色显示,人工输尿管结构和上皮细胞之间的肌层从正常的输尿管侧到颅侧和尾侧均有再生。可以观察到,随着周数的推移,肌肉层逐渐向内生长(如图7D,H,L,P)。然而,再生并不是完全持续的。
在正常的上皮细胞中,CK14检测结果呈阳性。CK14在人工输尿管结构的所有时期均为阳性(如图8A,D,G,J)。阳性细胞分布在人工输尿管结构中,随着时间的推移其数量略有减少。血管生成标志物VEGF在人工输尿管结构的所有时期均呈阳性,阳性细胞随着时间的推移,分布更加密集(如图8B,E,H,K)。Masson三色染色显示人工输尿管结构中有胶原纤维。随着实验的进行这些纤维变得更致密、更厚。
人工输尿管结构侧的平均横截面面积为0.097±0.002 mm²,健康输尿管侧的出血面积为0.072±0.002 mm²,人工输尿管侧平均略宽于健康侧。但两组间差异无统计学意义(如图6B)。
六、总结
在2-12周时,检查大鼠身体和病理特征。在0-1级肾积水大鼠的人工输尿管腔内,观察到输尿管上皮的再生,其厚度在实验过程中有所增加,肌肉层的再生也可以观察到。随着时间的推移,从正常的输尿管侧向人工输尿管结构延伸。然而,在12周结束时,没有观察到完全的再生。虽然所有病例均有输尿管蠕动,但比预期的要弱。因此,实验团队仅完成了短段输尿管再生。
在输尿管再生的临床背景下,使用人工输尿管结构的植入技术比传统的重建方法侵入性更小,值得进一步关注。采用膀胱壁的Boari皮瓣方法和采用回肠导管的尿路分流技术具有更高的侵入性,且并发症发生率高。而人工输尿管结构的移植技术比传统的重建技术侵入性较小。人工输尿管结构移植简单,不需要其他器官重建尿路。在这些方面,患者可以受益于其临床应用。
总之,这项研究发现,即使是一个无支架的细胞结构也可以用来在短距离内再生输尿管,几乎没有肾积水并保留其功能。然而,要实现输尿管长节段的再生和输尿管功能的完全再生,仍有待进一步的研究。此外,有必要在超过本研究12周的时间内观察人工输尿管结构的变化。尽管存在这些问题,这是第一个使用活细胞结构成功再生输尿管的报告,使本研究可能成为未来尿路再生研究的基石。

来源:和义广业创新平台


