今日头条
迈威生物IL-11单抗启动I期临床。迈威生物在ClinicalTrials.gov网站上登记启动一项I期临床试验(NCT05740475),评估9MW3811首次用于健康受试者的安全性、耐受性和药代动力学特征。9MW3811是一款抗IL-11的单抗药物,可通过结合IL-11有效阻断IL-11下游信号通路的激活。目前,全球仅有重组IL-11药物上市,均用于治疗化疗引起的血小板减少。
国内药讯
1.第一三共HER2-ADC在华获批上市。阿斯利康与第一三共联合开发、靶向HER2的ADC药物注射用德曲妥珠单抗获国家药监局批准上市,用于单药治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。在Ⅲ期临床(DESTINY-Breast03)中,与恩美曲妥珠单抗相比,德曲妥珠单抗使疾病进展或死亡风险降低72%(HR:0.28;95% CI:0.22-0.37;p<0.0001)。在美国,该药还被FDA批准用于治疗HER2低表达乳腺癌、HER2阳性胃癌和胃食管结合部腺癌患者等适应症。
2.诺华TPO-R激动剂在华获批新适应症。诺华非肽类口服TPO-R激动剂艾曲泊帕乙醇胺片(Eltrombopag 、瑞弗兰)获国家药监局批准新适应症。此前,该新药已在国内获批用于慢性免疫性(特发性)血小板减少症(ITP)的适应症。Eltrombopag是全球首款获FDA批准针对ITP的TPO-R激动剂口服药物。除ITP外,FDA还批准艾曲泊帕乙醇胺片用于治疗慢性肝病合并血小板减少症、再生障碍性贫血。
3.百济神州PD-1单抗获批新适应症。百济神州PD-1替雷利珠单抗(商品名:百泽安)第10项适应症获国家药监局批准上市,联合化疗一线治疗肿瘤表达PD-L1的晚期或转移性胃或胃食管结合部(G/GEJ)腺癌。在一项国际 RATIONALE 305(NCT03777657)研究中,与安慰剂联合化疗相比,替雷利珠单抗联合化疗显著延长PD-L1表达患者的总生存期(OS),而且临床中未出现新的安全性警示。
4.甘李甘精胰岛素向FDA报BLA。甘李药业生物类似药甘精胰岛素注射液的生物制品许可申请(BLA)获FDA受理。甘精胰岛素是赛诺菲原研的一款长效胰岛素类似物,又称基础胰岛素,仅需每天注射一次,用于糖尿病的治疗。根据赛诺菲2022年财报,甘精胰岛素产品Lantus®2022年的全球销售额为22.59亿欧元,其中美国市场的销售额为7.57亿欧元。
5.辉瑞SHP2抑制剂在华获批临床。辉瑞1类化药PF-07284892片获国家药监局临床试验默示许可,拟开发用于治疗晚期实体瘤。PF-07284892是一款SHP2抑制剂,该产品正在晚期实体瘤患者中开展首次人体Ⅰ期临床研究,评估用于单一药物以及与ALK抑制剂、BRAF抑制剂、MEK抑制剂、抗EGFR抗体等药物联合疗法的药代动力学、安全性和初步临床活性,并确定该产品的最大耐受剂量。
6.和铂B7H7单抗国内报IND。和铂医药1类生物制品HBM1020注射液的临床试验申请获CDE受理。HBM1020是和铂医药Harbour Mice® H2L2转基因小鼠平台开发的靶向B7H7的潜在“first-in-class”全人源单抗,旨在通过阻断免疫检查点靶点和配体的结合,增强抗肿瘤免疫。临床前数据已显示出HBM1020免疫激活和抗肿瘤的治疗潜力。FDA已于年初批准HBM1020在美国开展I期临床。
国际药讯
1.赛诺菲长效血友病A疗法获批上市。赛诺菲与Sobi公司联合开发的凝血因子VIII重组蛋白疗法Altuviiio(efanesoctocog alfa)获FDA批准上市,用以预防与治疗血友病A成人与孩童患者出血。在XTEND-1试验中,每周一次Altuviiio预防性治疗,显著降低患者的年出血率(ABR);与此前接受的凝血因子VIII预防性治疗相比,Altuviiio预估降低了约77%的年出血率。此前,FDA曾授予此疗法突破性疗法认定以及优先审评资格。
2.强生PARP抑制剂mCRPC适应症获CHMP推荐批准。强生旗下杨森开发的PARP抑制剂尼拉帕利获欧洲药品管理局人用药品委员会(CHMP)推荐批准上市,联合泼尼松或泼尼松龙一线治疗临床上无化疗指征且携带BRCA1/2突变的转移性去势抵抗性前列腺癌(mCRPC)成年患者。在III期MAGNITUDE研究中,联合治疗显著延长HRR(同源重组修复)阳性患者的影像学无进展生存期(rPFS)(16.5vs13.7个月;HR=0.73),和BRCA1/2突变患者的rPFS(16.6vs10.9个月;HR=0.53)。
3.再生元阿柏西普高剂量制剂获优先审评。再生元与和拜耳联合开发的8 mg剂量水平的aflibercept的生物制品许可申请(BLA)获FDA受理,用于治疗湿性年龄相关性黄斑变性(wAMD)、糖尿病性黄斑水肿(DME)和糖尿病性视网膜病变患者。FDA同时授予其优先审评,PDUFA日期为今年6月27日。在临床试验中,与8周一次Eylea治疗组相比,每12周一次或每16周一次8 mg aflibercept给药组患者的视力改善达到非劣效性标准。
4.GSK长效HIV复方III期临床成功。葛兰素史克长效HIV药物Cabenuva(卡替拉韦+利匹韦林)治疗HIV-1感染的III期SOLAR研究达到主要终点。该项研究评估HIV-1成人患者从服用Biktarvy(比克替拉韦+恩曲他滨+丙酚替诺福韦,每日1次) 转为注射Cabenuva(每2个月1次)的疗效和安全性。结果显示,Cabenuva治疗后实现血浆HIV-1 RNA≥50拷贝/mL的患者比例与Biktarvy组相比达到非劣效性(1% vs <1%)标准。
5.安斯泰来庞贝病基因疗法早期临床积极。安斯泰来AAV基因疗法AT845治疗迟发型庞贝病(LOPD)的Ⅰ/Ⅱ期FORTIS试验最新数据积极。AT845旨在通过AAV8载体将GAA基因的功能性拷贝直接输送到患者肌肉细胞中。GAA基因可在受疾病影响的组织(包括骨骼肌和心肌)中有效转导以直接表达GAA。结果显示,4例患者中有3例在接受一次性的AT845治疗后停用酶替代疗法(ERT),且停用51周时的功能检测结果依然保持稳定。
6.罗氏退回RET抑制剂普拉替尼权益。出于战略原因,罗氏日前终止与Blueprint Medicines公司关于RET抑制剂Gavreto(普拉替尼)的全球合作协议,将该药物的商业化和开发授权归还给Blueprint。普拉替尼目前已获FDA和NMPA批准上市,用于治疗RET基因融合阳性非小细胞肺癌、甲状腺髓样癌和甲状腺癌患者。2018年6月,基石与Blueprint 签订合作许可协议,获得该新药在大中华地区的开发与商业化权利。
医药热点
1.徐斌任四川省卫健委主任。2023年2月23日,四川省第十四届人大常委会第一次会议第二次全体会议,表决通过了省人民政府省长向省人大常委会提出的任免案:决定任命徐斌为四川省卫健委主任。根据公开资料,徐斌出生于1965年4月,四川荣县人。1985年,徐斌就读于重庆医科大学儿科系儿科专业,1990年本科毕业后,进入四川省卫生厅工作。疫情三年来,徐斌的工作多围绕疫情展开,主管全省防疫工作。
2.成都全面启动孕产妇抑郁症筛查。2月23日,成都市卫健委宣布正式启动成都孕产期抑郁症筛查工作。这是西部地区首个落地孕产妇抑郁症筛查的城市。根据《成都市孕产妇抑郁症筛查工作方案(2023年版)》,成都市卫健委计划逐步建立完善孕产抑郁症筛查体系和转会诊工作机制,力争到2025年,成都市孕产妇抑郁症筛查率提高到90%以上,孕产期保健医务人员抑郁症防治培训率达到 90%以上,目标人群抑郁症防治知识知晓率达到 90%以上。
评审动态
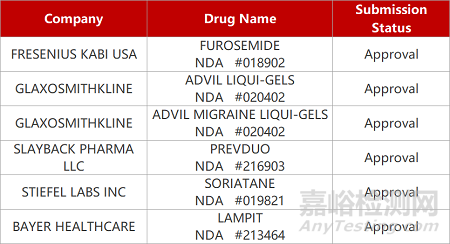
FDA新药获批情况(北美02月23日)