自2015年药品审评审批制度改革启动以来,我国药品在上市数量与上市速度上均显著提升,进一步助推我国创新药实现快速发展。在第六届中国药品监管科学大会上,CDE副主任杨志敏介绍了近年药品审评总体情况与加快药品审评工作的相关举措。透过近5年相关药审数据的变化,可以看到我国药品在申报审批上呈现出的一些新特点。
中药注册申请翻倍最多
2018-2022年,药品注册申请受理量与审结量逐年增加,且保持了10%以上的高增速。其中,受理量由2018年的7338件增长到2022年的12368件,年均增长13.9%;审结量由2018年的7611件增长到2022年的11365件,年均增长10.5%。
从药品类型来看,中药增速最快,增加的倍数最多。在受理量上,中药年均增长39.4%,2022年为2018年的3.8倍;在审结量上,中药年均增长41.1%,2022年是2018年的4.0倍。
创新生物制品增速领衔
在审评审批制度改革的助推下,创新药更是快速步入“收获期”。2018-2022年,我国累计有109个创新药品种获批上市,其中包含12个同类首创新药(first-in-class)。创新药的申报与审批也跑出了不一样的“加速度”,除了NDA受理量年均增长(2.6%)略微平稳,创新药其他方面的增速都十分显著。具体来看,2018-2022年,创新药IND申请受理量与批准量年均增长分别达到35.5%与28.5%;创新药NDA批准量年均增长26.4%。
从药品类型来看,生物制品在创新药中“独领风骚”,尤其是在IND的受理量与批准量增速上遥遥领先。2018-2022年,创新生物制品IND受理量年均增长55.1%,2022年为2018年的5.8倍;创新生物制品IND批准量年均增长53.4%,2022年为2018年的5.5倍。
儿药/罕见病药上市提速
此外,备受关注的儿童用药、罕见病药与临床急需境外新药也在各项鼓励政策的推动下加速上市。儿童药与罕见病药在临床研究等方面存在不少难题,为构建和持续推进技术评价体系建设,CDE发布了一系列指导原则。随着相关政策的推进和完善,近年儿童药与罕见病药的获批数量逐步增加。
例如,儿童用药批准由以前的个位数,从2019年开始快速增加,2022年获批品种数达到66个,比2021年增长40%。在罕见病药方面,《第一批罕见病目录》的121个病种中,77种疾病在国内已有治疗药物。罕见病用药的注册申请(临床和上市)受理量,从2017年的46个,增加到近两年的140个左右。在临床急需境外新药方面,已发布的3批名单共涉及81个品种,目前已有54个获批,占总数的67%。
四大加速程序要点解读
为了使真正的好药尽早尽快上市,真正地实施以患者为中心的药物研发,2020年7月1日起实施的新版《药品注册管理办法》提出了四大加快上市注册程序:突破性治疗药物程序、附条件批准程序、优先审评审批程序与特别审批程序。
杨志敏强调,要保证新药越快越好地上市,基于全生命周期的风险管理变得异常重要。不仅是药品的临床试验、质控、工艺,还要关注临床试验中的风险管控及上市后的风险管控,加强创新药上市后的全生命周期管理工作。
据其介绍,特别审批程序主要针对发生突发公共卫生事件的威胁,在突发公共卫生事件后应急所需防治药品,如新冠这样的突发公共卫生事件就属于特别审批程序。除此之外,绝大多数患者特别急需的药品或数据具备显著优势的药品,往往适用于其他三种程序。
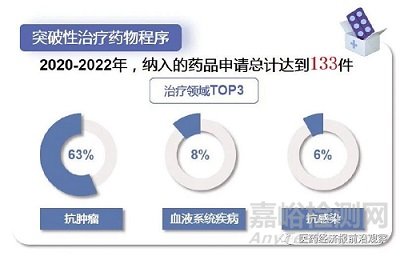
具体来看,一个药物的早期数据若能显示出比现有疗法具备显著优势,就有机会获得突破性治疗药物的资格,其评价标准关键在于患者的获益。一旦得到该资格,就能获得审评资源的倾斜,如沟通交流、后续的优先审评等。因此,突破性治疗药物程序类似于一个资格认证。
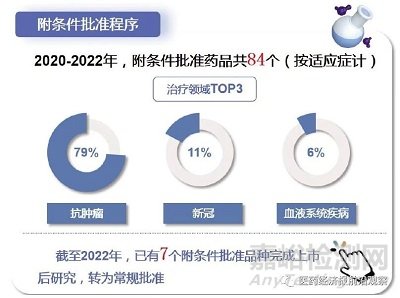
附条件批准程序的目的在于缩短药物临床试验的研发时间,使其尽早应用于无法继续等待的危重疾病或公共卫生方面急需的患者。比如采取单臂试验、替代终点等,力求在非常早期就看到获益指标,其更类似于一种技术标准。但杨志敏强调,不能把附条件批准当成简化上市的一个标准,而是把这种标准转化为提前让患者有可获得性的一种以患者为中心的方式。附条件不是降低标准,而是更高标准。
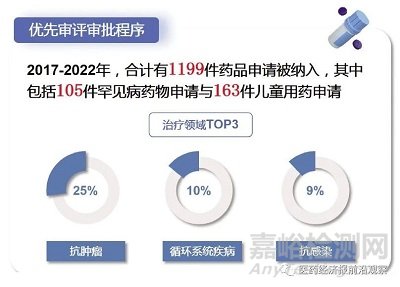
早期被列入突破性治疗药物程序和附条件批准程序的品种,后续就可以列入优先审评审批程序,这才是真正缩短时限的一个审评程序,类似程序VIP。在审评时间不断缩短的情况下,优先审评的时间仍显著低于普通品种。以2022年为例,普通品种与优先审评审批品种的审评用时分别为234日与144日。
(数据来源:CDE;制图:连莹莹)
在药品审评审批制度改革的催化下,我国创新药行业实现了高速增长。随着改革持续深化,药品审评标准体系建设进一步完善,医药行业的高质量发展将得到更大助力。