今日头条
贝来干细胞疗法获批老年痴呆临床。贝来生物1类生物制品“人脐带间充质干细胞注射液”获国家药监局批准开展针对阿尔茨海默病适应症的临床研究。2020年7月,国际期刊《Advanced Science》在线发表了军事科学院军事医学研究所等研究团队的研究成果表明:脐带间充质干细胞(hUC-MSCs)具有修复损伤神经细胞的功能,能够通过HGF-cMet-AKT-GSK3β通路调节tau蛋白磷酸化,显著提高阿尔茨海默病模型动物的学习记忆和认知能力。
国内药讯
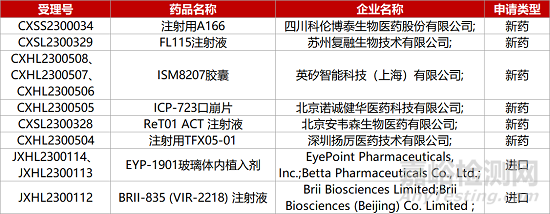
1.科伦HER2-ADC报产。科伦药业靶向HER2的ADC药物A166的上市申请获CDE受理,用于既往经二线及以上抗HER2治疗失败的HER2阳性不可切除的局部晚期、复发或转移性乳腺癌。A166能够靶向HER2表达的肿瘤细胞,通过内吞进入细胞后,在胞内溶酶体中切割并释放毒素分子高效杀伤肿瘤细胞,兼具抗体药物的靶向性以及传统化疗药物的高杀伤性等特点,是科伦博泰首个提交上市许可申请的ADC药物。
2.再鼎引进「瑞普替尼」拟纳入优先审评。再鼎医药从Deciphera公司引进的酪氨酸激酶抑制剂瑞普替尼(Ripretinib)的新适应症上市申请获CDE拟纳入优先审评,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者。Ripretinib是全球获批用于四线治疗晚期胃肠道间质瘤(GIST)患者的首款新药,在Ⅲ期临床INVICTUS中,Ripretinib显著降低GIST患者85%的疾病进展或死亡风险。2021年3月,该新药用于治疗GIST已获批国内上市。
3.远大医药引进RDC获批I期临床。远大医药从Isotope公司引进的肽受体放射性核素偶联药物(RDC)ITM-11获国家药监局临床默示许可,拟开展单臂、开放标签I期临床,评估治疗胃肠胰腺神经内分泌瘤(GEP-NETs)的安全性、辐射剂量学和药代动力学特征及初步有效性。ITM-11将无载体177Lu与生长抑素类似物偶联,通过与GEP-NETs表面高水平表达的生长抑素受体(SSTR)结合靶向杀伤肿瘤细胞。去年年底,该新药已获得FDA授予快速通道资格。
4.阿斯利康ASO药物中国报IND。阿斯利康1类化药eplontersen注射液的临床试验申请获CDE受理。这是一款反义寡核苷酸(ASO)疗法,已于今年3月在美国递交上市申请,治疗遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性多发性神经病。公布于AAN年会上的III期NEURO-TTRansform研究66周分析数据显示,与安慰剂相比,eplontersen治疗显著降低患者血清TTR浓度较基线的降幅(82%vs11%,p<0.0001)。
5.迈威B7-H3靶向ADC报IND。迈威生物1类生物制品“注射用7MW3711”的临床试验申请获CDE受理。7MW3711是一款靶向B7-H3的ADC药物,可与肿瘤细胞表面的抗原结合进入肿瘤细胞,通过特定酶解作用,定向释放小分子,从而实现对肿瘤的精准杀伤。在临床前研究中,7MW3711在多种动物肿瘤模型中均显示出积极的肿瘤杀伤作用;并在食蟹猴等动物安全性评价模型中显示出良好的药物安全性及药代特性。
国际药讯
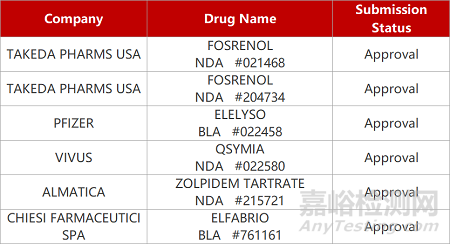
1.阿斯利康C5补体抑制剂获批新适应症。阿斯利康长效C5补体抑制剂Ultomiris(ravulizumab)获欧盟批准新适应症,用于治疗抗水通道蛋白4抗体阳性的视神经脊髓炎(NMOSD)。在III期CHAMPION-NMOSD研究中,中位治疗为73周时,Ultomiris较安慰剂降低98.6%(p<0.0001)的疾病复发风险。在美国,该药已获批治疗多种自身免疫性疾病,包括阵发性睡眠性血红蛋白尿、非典型溶血尿毒综合征以及全身型重症肌无力。
2.法布里病创新疗法获FDA批准上市。Chiesi Global Rare Diseases与Protalix公司联合开发的聚乙二醇化酶替代疗法(ERT)Elfabrio(pegunigalsidase alfa)获FDA批准上市,用于治疗法布里病成年患者。在关键Ⅲ期临床中,与酶替代疗法agalsidase beta相比,Elfabrio治疗组患者24个月时肾功能改善达到非劣效性标准,而且药物总体耐受性良好。5月初,该新药也在欧盟获批上市。
3.高剂量阿柏西普启动头对头III期研究。拜耳8mg剂量水平阿柏西普启动一项III期QUASAR研究,旨在评估与标准治疗方案Eylea(阿柏西普2mg)相比,用于继发于视网膜静脉阻塞(RVO)的黄斑水肿中以延长治疗间隔的方式给药的有效性和安全性。今年2月份,aflibercept的生物制品许可申请(BLA)已获得FDA受理,FDA同时授予其优先审评,PDUFA日期为今年6月27日。
4.BI双重激动剂减肥Ⅱ期临床积极。勃林格殷格翰与Zealand Pharm联合开发的GLP-1/GCG双重激动剂BI 456906,在治疗肥胖症或无2型糖尿病的超重患者的Ⅱ期临床达到主要终点。与安慰剂相比,BI 456906皮下注射治疗显著减少患者46周后的体重,体重减轻高达14.9%。完整数据将在2023年美国糖尿病协会年会上公布。此前,该新药已获得FDA授予用于治疗非酒精性脂肪性肝炎(NASH)的快速通道资格。
5.吉利德收购生物技术公司XinThera。吉利德宣布收购位于圣地亚哥的生物技术公司XinThera,并获得该公司肿瘤学PARP1小分子抑制剂和炎症&免疫学MK2小分子抑制剂共5项处于IND的早期管线资产。PARP1小分子抑制剂能够促进PARP1在DNA上的截留,但不截留PARP2,从而减轻一代PARP抑制剂造成的血液学毒性副作用,同时在同源重组缺陷(HRD)的癌症模型中表现出皮摩尔浓度的选择性抗肿瘤活性。本次收购具体收购价格暂未披露。
6.盐野义2022年新冠药收入8亿美元。5月10日,盐野义制药公布2022财务报表,公司总营收4267亿日元(约为32.68亿美元),同比增长27.3%;净利润1490亿日元(约11.41亿美元),同比增长35.1%;研发投入1024亿日元(约7.84亿美元),同比增长40.3%。其中,新冠药物Xocova(ensitrelvir)在本财年收入1047亿日元(约8.02亿美元),占总收入25%。
7.拜耳17亿美元开发多款RDC。拜耳与Bicycle Therapeutics将利用后者开发双环肽的专有噬菌体平台,针对拜耳指定的多个肿瘤靶标,合作开发放射性偶联候选药物。根据协议,Bicycle将获得总计高达17亿美元的款项,包括4500万美元的预付款,以及开发和商业化的里程碑潜在付款。拜耳将负责候选药物的进一步的临床前和临床开发、生产和商业化活动。
医药热点
1.肯尼亚发生不明传染病。据肯尼亚卫生部当地时间10日表示,该国马萨比特郡出现不明传染病,已致9人死亡,另有80多人感染。当地医护人员表示,大部分患者出现流感症状、眼睛发黄并伴有严重头痛。首例病例出现在两周前,他们已及时上报卫生部,并对患者进行检测,由于部分患者疟疾检测呈阳性,所以卫生部表示不排除当地暴发疟疾疫情的可能性。
2.抗生素无处方销售问题严峻。近日,华中科技大学同济医学院公共卫生学院殷晓旭教授团队在国际期刊《柳叶刀·传染病》上发表综述,系统阐述全球零售药店抗生素无处方销售现状及其相关因素。分析结果显示,全球零售药店抗生素无处方销售率高达63.4%,低收入国家显著高于高收入国家。当前全球零售药店抗生素的无处方销售仍然较为严峻,近20年来零售药店抗生素的无处方销售状况无明显改善,有必要重新审视当前的政策法规。
3.日本科学家发现肿瘤内细菌可发挥溶瘤作用。2023年5月7日,日本先进科学技术研究所的研究人员在《Advanced Science》发表了研究论文。该研究表明,与天然光合细菌相关的肿瘤内细菌具有生物相容性和较强的免疫原性抗癌作用。它们优先在肿瘤环境中生长和增殖,这有效地导致免疫细胞浸润肿瘤,并在小鼠模型中产生强烈抗癌效果,显著延长其生存期。
评审动态
1. CDE新药受理情况(05月11日)
2. FDA新药获批情况(北美05月10日)