超说明书用药(OLDU),又称药品未注册用法,是指药品使用的适应症、给药剂量、适用人群或给药途径等不在药品监督管理部门批准的说明书之内的用法。2022年3月开始实施的《中华人民共和国医师法》(以下简称《医师法》)首次在法律层面明确了医生可以进行合理的超说明书用药,并规定仅在尚无有效或者更好治疗手段等特殊情况下,医师取得患者明确知情同意后,可以采用药品说明书中未明确但具有循证医学证据的药品用法实施治疗,同时,医院应当建立相应的管理制度。尽管超说明书用药已经被法律允许,但我国仍未出台超说明书的实施细则,包括循证医学证据具体要求、患者权益保护、医院管理制度要求及医保支付等。欧盟目前已经有法国、德国、英国等10个国家制定了法律来规范超说明书使用。法国建立了完善具体的法律监管框架,即同情处方框架(CPC),也是欧盟目前唯一需要监管部门审查许可的国家。
本文通过研究CPC框架下超说明书用药的审批、公布、监测和医保报销机制,结合我国超说明书用药监管存在的问题,提出相应的完善建议,为我国超说明书用药监管建设提供参考。
一、我国超说明书用药的监管现状
我国在2021年由全国人大常委会通过并实施的《医师法》中首次明确了超说明书用药的合法性。在此之前,超说明书用药未被法律明确规定。2007年原卫生部颁布实施的《处方管理办法》第十四条第一款规定“医师应当根据医疗、预防、保健需要,按照诊疗规范、药品说明书中的药品适应症、药理作用、用法、用量禁忌、不良反应和注意事项等开具处方。”但诊疗规范没有明确的规定,在一些诊疗指南中也存在着超说明书用法的推荐。因此,我国此前临床超说明书用药的现象普遍而混乱,实践中医师常常根据临床经验、专家共识而进行超说明书用药,缺乏对超说明书用药条件、证据质量的判断。
为了满足临床诊疗的需求,我国的一些行业协会和医疗机构制定了一系列超说明书用药的指导性文件,以规范药品超说明书用药活动,以此降低法律风险和医疗损害事件的发生。目前,我国临床诊疗过程中的超说明书用药的实施规范依据,主要为行业协会和学术机构发布的指导性原则。
二、法国超适应症用药的监管框架
2012年第742 号法令公布实施的超说明书用药监管框架,即临时推荐用药(RTU),要求超说明书用药提交审查,审查通过才可以合法使用,并同步修改了《民法典》《公共卫生法》《社会保障法》中的要求,该框架由法国国家医药卫生产品安全局(ANSM)负责实施。RTU框架包括了超说明用药的申请、审查、授权、更新、患者监测保护、持续风险评估、暂停、撤销及终止全流程的要求。2021年,ANSM更改了RTU框架,改名为同情处方框架(CPC),该框架增加了新的申请条件,即申请的超说明书用法必须未开展商业化研究(包括欧盟以外的商业研究)。
法国实行审批制度,由需要超说明书用药的机构药房的药剂师向ANSM提交申请,ANSM在收到申请后通知拟使用药品的上市许可持有人(MAH)提供支持审查的研究资料和治疗使用及患者监测方案,最后由ANSM组织专家进行风险收益的评估。具体流程如图1所示。
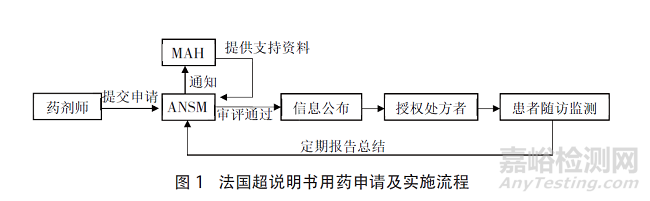
在法国CPC框架之下,超说明书用药的评估涉及了3个责任主体的参与,分别是处方申请药剂师、药品提供者MAH、监管者ANSM。治疗使用和患者监测方案是法国申请超说明书用药的重要前提条件,法国要求MAH在申请后提供治疗使用和患者监测的方案,并进行审批。在处方者开具处方前,应当取得患者的知情同意,处方者和药剂师负责用药后的信息收集工作并且应当签订ANSM的治疗使用和数据收集协议。
ANSM要求获得超说明书用药许可的MAH提交定期总结报告,报告内容应当包括在实施方案的背景下收集的所有信息的摘要,这些信息涉及医药产品的使用条件、有效性和安全性,以及任何可能导致改变对医药产品的效益/风险比评价的信息,以及对医药产品的风险-效益平衡的分析。
ANSM建立了一个超说明书用药数据库,在纳入CPC程序之后,该药品的超说明书使用信息将收入到该数据库。公示信息包括该药品纳入CPC的标准和使用说明,患者治疗使用、随访协议和定期总结报告的摘要。信息公开将有利于处方医生的合理用药,通过检索该数据库确定超说明书用药的处方是否获得审批,另外这也有利于公众监督和后续的风险收益评估。
三、相关建议
1.完善法律体系,加强患者保护
超说明书用药具有合理性和必然性,虽然《医师法》明确了超说明书用药的条件,但目前仍没有国家政府层面的统一实施细则文件。我国的行业协会和学术机构已经发布了一些专家共识,并且被部分医院使用。我国的卫生管理、药品管理等相关部门应在此基础上结合医疗机构的执行情况,尽快确定和发布超说明书用药的实施细则,主要包括循证医学证据要求、诊疗实施规范、患者保护要求,规范诊疗过程,保护医生和患者的合法权益。患者保护是实施过程中的核心要求,也是此前发生法律案件判决时的关键影响因素之一,但在此前的临床实践过程中患者保护意识薄弱,缺乏患者保护措施。建议我国尽快出台超说明书患者保护的具体要求,与患者签订知情同意书并告知用药的目的和条件、药品配备和使用方法、监测随访程序、可能的风险和收益以及风险防治方案。
2.制定动态目录,提供使用依据
广东省药学会自2015年开始制定并最终发布《超药品说明书用药目录》,但该目录仅作为推荐参考,缺乏强制执行力。我国可借鉴法国的数据库建设做法,制定我国的超说明书用药的动态目录。首先,监管部门应当确定超说明书用药的纳入要求,再将符合要求的超说明书用药信息公开,为医生的超说明书用药提供依据,降低法律风险。另外,该公开目录可结合处方前置审方制度和处方点评制度,加强用药前后的审批,减少不合理用药的发生。
3.加强后续监测,持续评估安全性与有效性
后续的监测随访既可以起到保护患者安全的作用,同时也可以收集治疗数据,更新超说明书用药的安全性与有效性数据,提供新的论证证据。法国监管框架提供了一个新的思路,建议多主体参与监测评估过程,由医生和药剂师负责随访监测和收集数据,药品生产企业整合、分析数据,评估药品的安全性和有效性,并向监管部门定期提供总结报告。监管部门根据数据,持续评估风险收益平衡,及时阻止可能存在风险的情况发生,保护患者安全。对于安全性与有效性持续良好的超说明书用法,药品生产企业和监管部门可以加强沟通,探索该用法申报注册和加速审评的可能性,尽早完成药品说明书更新,降低使用风险。





