您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-01-18 12:44
摘 要Abstract
本文以药品生产质量管理规范符合性检查为例,具体分析医疗产品良好监管规范(GRP)的合法性、一致性、独立性、公正性、均衡性、灵活性、清晰性、效率性和透明度九大原则的基本内涵,探究其在药品检查质量管理体系中的体现。以GRP 原则为基础,结合药品检查合作计划(PIC/S)和世界卫生组织(WHO)对药品检查机构评估的要求,提出我国药品检查机构质量管理体系评价体系、评价要素和评价方法,以期为我国建立省级药品检查机构质量管理体系评估方法、各级药品检查机构建立和改进质量管理体系提供借鉴参考。
The paper takes GMP compliance inspection as an example to elaborate on the fundamental connotation of GRP's nine principles: legality, consistency, independence, impartiality, proportionality, flexibility, clarity, efficiency, and transparency.It further explores how these principles are embodied within the quality management system of drug inspection institutions.Based on the GRP principles and combined with the requirements of PIC/S and WHO for assessing drug inspection institutions,the paper proposes an evaluation system, indicators, and methods for assessing the quality management systems of drug inspection institutions in China. The evaluation system provides reference for establishing assessment methods for provinciallevel drug inspection institutions and for drug inspection institutions at all levels in establishing and improving their quality management systems in China.
关键词Key words
医疗产品良好监管规范;质量管理体系;检查机构;国家监管体系;GMP 符合性检查;药品检查合作计划
Good Regulatory Practices in the Regulation of Medical Products; quality management system; inspection institutions; National Regulatory Authorities; GMP compliance inspection; Pharmaceutical Inspection Co-operation Scheme
自2011 年我国疫苗监管体系首次通过世界卫生组织(World Health Organization,WHO)对国家监管体系(National Regulatory Authorities,NRA)的评估以来,质量管理体系成为药品检查机构的热议话题和重要的工作目标[1]。2021 年国家药监局发布的《药品检查管理办法(试行)》明确要求,药品检查机构应当建立质量管理体系,保证药品检查质量,质量管理体系成为药品检查机构的基本要求。2023 年我国向药品检查合作计划(Pharmaceutical Inspection Co-operation Scheme,PIC/S)提交了正式加入申请,建立全国统一的、符合国际标准的质量管理体系更为迫切[2]。目前,虽然我国国家级、省级药品检查机构陆续通过了ISO9000 质量管理体系认证,但我国尚未出台统一的药品检查机构质量管理体系标准[3-4]。
2021 年WHO 发布了医疗产品良好监管规范(Good Regulatory Practicesin the Regulation of Medical Products,GRP),为各监管机构制定或实施各类监管文件提供了指导原则和规范,是最佳监管实践的基础,也为各级药品检查机构建立质量管理体系提供了遵循依据[5]。
药品检查是药品监管活动的重要环节, 本文以药品生产质量管理规范(Good Manufacturing Practice,GMP)符合性检查为例,具体分析GRP 的合法性、一致性、独立性、公正性、均衡性、灵活性、清晰性、效率性和透明度九大原则的基本内涵,探究其在药品检查质量管理体系中的具体体现。进而以GRP 原则为基础,提出我国药品检查机构质量管理体系评价体系、评价要素和评价方法。
1、 GRP 的原则及内涵
1.1 合法性原则
合法性是药品检查机构运行的基础。在PIC/S 对药品检查机构的78 项评估指标中,有23 项是关于法律法规的要求[6-8],充分说明了依法开展药品检查工作的重要性。对药品检查机构来说,合法性的内涵体现在以下3 个方面。
(1)职能法定。药品监管部门依《药品管理法》规定,设置或者指定药品专业技术机构承担检查工作。
(2)明确“三定”方案。药品监管部门或其他上级主管单位关于设立检查机构的相关文件中,需明确关于主要职责、内设机构和人员编制的规定。
(3)与其他单位的职责分工与沟通协调机制。主要包括3 个层面:一是药品检查机构与药品监管部门的协调机制。药品检查机构原则上不能自行发起检查,需要有明确的任务来源,这个来源通常是药品监管部门;检查员通常不具有行政执法资格,如果检查现场需要有执法资格的人员,需要药品监管部门协调调配;检查结果的处置原则上由药品监管部门实施,需要药品检查机构有明确的信息报送程序。二是药品检查机构与药品检验机构的协调机制。一方面药品检查抽取的样品需要送药品检验机构进行检验,另一方面检验发现的质量问题需报告药品监管部门后,由药品监管部门协调启动现场检查。三是涉及多个检查机构共同承担检查职责时,例如检查分中心、检查分局之间的沟通协调,特别是程序和标准相一致尤为重要。
1.2 一致性原则
检查机构开展检查活动应当符合法律、法规、规章等要求,应当与国家药监局发布的各类规范性文件保持一致,这是国家和地方执行检查一致性的保证。在PIC/S 对检查机构的评估中,一致性是最重要的原则之一,国家级与省级、不同省级之间、不同检查组之间的程序和标准一致性是通过PIC/S 评估的关键指标。对于检查机构的质量管理体系,一致性的内涵体现在以下4 个方面:①文件体系及时更新,检查程序或标准与上位法和上级单位的要求保持一致。②检查的目的是为了让行业在执行GMP 规范时保持一致。为促进行业执行的一致性,一是需要有充分、明确的检查指南;二是保证药品检查机构与行业的沟通交流顺畅;三是允许企业对检查结果进行申诉。这些措施都可以加强行业对GMP规范的理解,进而促进实施的一致性。③检查报告由检查组以外有资质的人员进行常规审核,特别是对检查缺陷的条款适用与分级、检查结论与缺陷的匹配性等,进而消除检查组之间的差异和偏见,保证检查尺度的一致。④在绩效指标、内审、外审等质量管理活动中,通过设置一致性相关指标进行强调和考核,可在促进一致性方面发挥重要的作用。
1.3 独立性原则
药品检查机构的独立性是指独立于被监管对象,能够独立、权威和公正地开展检查。WHO和PIC/S 对检查机构和检查员“利益冲突”防范的要求[6,9] 均是出于检查独立性的考虑。检查机构的独立性要求包括以下2 个方面:①财务独立。政府提供充足的预算,满足检查工作的正常开展。避免由于经费不足而过分依赖行业的经费支持,对检查独立性造成破坏。②检查员须遵守法律法规、廉洁纪律和工作要求,不得与被检查单位有利害关系,检查前签署无利益冲突声明。检查机构应建立廉政风险防控机制,并制定防控措施。
1.4 公正性原则
公正性既是WHO、PIC/S对检查机构的评估要求,也是依法行政的基本要求。2020 年版《药品生产监督管理办法》要求,现场检查结束后,应当对现场检查情况进行分析汇总,并客观、公平、公正地对检查中发现的缺陷进行风险评定并作出现场检查结论。这也是检查公正性的具体体现。对于检查机构来说,公正性不仅是技术要求,还应在制度的制修订中更多地考虑公正性原则,这些制度与一致性、清晰性、透明度等原则都密切相关,也是保障公正性的重要支撑,具体体现在以下3 个方面:①检查机构不应从事其检查的行业活动,也不应隶属于被监管的机构,避免存在利益冲突。②检查机构应建立基于科学和风险的工作方法,包括基于风险制定检查计划的原则、基于风险的检查缺陷分级和结果判定原则等。这些原则在规范检查决策的同时起到进一步减少自由裁量的作用。同时,这些原则需要公开透明,给行业提供便捷获取的渠道、明确的指导和稳定的预期。③如果在检查工作中需要利用外部专家(包括参加现场检查、技术审核等),专家的管理对于检查机构公正性影响至关重要。一是外部专家只提供技术意见,对检查相关决策提供咨询建议,但不参与行政决策。二是应建立专家管理制度,明确外聘专家资格,规范对外聘专家的聘任、考核等管理。三是对外部专家实行利益冲突回避的管理。
1.5 均衡性原则
均衡性原则要求监管的实施程度与资源、能力、风险相适应,适用于药品监管体系的所有要素。WHO 认为[5],世界上绝大多数的药品监管机构都面临着监管资源不足的挑战,正因如此,监管互信、基于风险的检查等机制被不同的监管机构所采纳。在药品检查领域,检查资源与检查需求的矛盾更为突出,从行业发展的角度来说,接受检查次数也并非越多越好。因此,均衡性原则在检查质量管理体系中有着非常具体的体现, 主要包括以下3 个方面。
(1)基于风险确定检查频次。2020 年版《药品生产监督管理办法》规定了生产企业的检查频次,例如,无菌药品等高风险药品生产企业至少每年开展一次GMP 符合性检查。在符合相关规章要求的基础上,还应结合企业的固有风险和合规风险确定检查频次,固有风险包括场地、品种和工艺的复杂程度,合规风险主要是指上一次检查缺陷和整改情况。对于固有风险和合规风险整体较高的企业,要适当增加检查频次,投入相对较多的检查资源。
(2)基于风险的检查实施。在每一次检查的实施过程中,检查资源的分配和检查重点的确定仍然要体现均衡性原则。一是基于风险确定本次检查的广度和深度,对于上次没有重点检查或者检查发现问题较多的领域,本次可以重点检查。二是在检查中发现问题较多的领域,可以投入更多的资源进一步深入检查,甚至可以调整检查方案(重大变更需要经过药品检查机构的同意),使检查的深度与发现的问题相适应,避免采用“清单式”的检查方法,对每个领域投入相同的精力。
(3)检查员的数量与检查工作相适应。检查机构应配备充足的检查员,以满足检查任务的要求,确保检查任务在时限内完成。如果检查员数量不足,可能导致检查任务超时或无法完成;但闲置检查员数量过剩(特别是兼职检查员)也是WHO 和PIC/S 不提倡的,检查能力的保持将成为挑战。
1.6 灵活性原则
药品监管的根本目的是保障药品安全、有效和可及,在应对新技术的创新应用、不断变化的监管环境以及不可预见的公共卫生威胁时,一个灵活、及时、有效的监管框架尤为重要,这就是监管的灵活性原则。它的前提是基于风险,不应损害产品的质量、安全性和有效性。在新冠疫情期间,新冠疫苗和新冠治疗药物的附条件批准和加快审评审批程序就是灵活性原则的具体体现。药品检查领域所应对的环境更为复杂,灵活性原则的重要性尤为凸显,具体体现在以下2 个方面。
(1)法规的要求是基于绩效而非规定性的。我国的药品GMP规定,企业可以采用经过验证的替代方法,达到本规范的要求。这个规定充分体现了灵活性原则,WHO 发布的GMP 中也有同样的表述。在制定法规时,除非执行上位法的要求必须规定做法,在技术层面的要求都可以保持一定的灵活性,即只规定目标,允许采用其他合理的方式实现合规,这样也为新技术的应用留有空间。
(2)完善的技术指南体系。技术指南是法律法规在实施层面的重要监管工具,通常不具有法律效力,但更详细、更灵活、更便于修订,因此完善的技术指南既能满足监管的需求,又不阻碍新技术创新的发展和应用。药品检查机构的技术指南体系越丰富,应对新的监管环境的能力越强。
1.7 清晰性原则
清晰性原则主要是为了指导行业和规范监管行为。监管部门首先要有清晰准确的法规表述,当法规不能规定所有的细节时,要制定指南等配套细化文件指导实施,使行业能够完整准确地理解监管要求和技术标准,同时给行业提供明确的发展方向和预期。同时,监管部门也需要规范各类文书的语言,进一步提高监管信息的利用率。具体体现在以下3个方面。
(1)根据检查相关法律法规和规范,制定或更新相应的管理规定、指南、技术文件和程序文件等。清晰性原则要求首先确保行业对检查要求的准确认知和合理预期,因此检查的相关文件要使用与法律法规一致的内容、标准的术语、规范的语言。当机构职责、法律法规、规范等发生变化后,相关文件要及时更新。
(2)制定程序文件,明确规定检查工作中各类文件的标准格式和要求。以检查报告为例,内容要客观、准确地反映现场检查的实际情况,并符合其标准化文件的要求。明确的格式是检查信息交互的基础,在推进检查互认互信中具有重要作用。
(3)检查发现的缺陷应以客观事实为依据,以法规和技术要求为准绳。要求对检查缺陷的表述采用规范化的语言,最好制定检查缺陷的术语集,对于同一类型的问题表述规范一致,可为检查结果的进一步汇总分析、有效利用奠定基础。
1.8 效率性原则
效率性是指监管部门在规定的时限内,以合理的投入实现预期的结果。对检查机构来说,首先要制定适宜的发展规划,根据检查任务的需求,合理配置人力资源、不断优化检查程序、提升检查员能力、监控关键绩效指标和评价检查工作效率。具体体现在以下5 个方面。
(1)制定机构发展规划,统筹检查程序、检查资源和能力、质量管理体系、信息化等方面的建设,实现资源利用最大化。
(2)明确检查工作时限,对于检查实施、整改报告审核、综合评定等关键环节科学设定时限,重点关注需要多部门配合的环节。设定时限提醒和控制方法。
(3)实现信息化管理,建立检查员信息平台,实现检查员信息共享和检查工作协调联动,建立检查信息数据库,高效利用检查历史信息,基于风险制定检查计划。
(4)制定检查的关键绩效指标并定期监测,例如检查次数、检查超期次数、检查报告报送时间、检查偏差发生次数等,这些监测将有助于衡量检查工作的有效性和效率性,以便进一步调整和优化资源配置。
(5)配备检查所需的设施、设备,对于飞行检查等特殊检查类型,配备必要的通讯、取证等设备,提高检查工作的效率。
1.9 透明度原则
透明度是监管工作成熟度的重要标志, 在WHO 制定的全球基准评估工具(Global Benchmarking Tool,GBT)中,各个板块均设置了与透明度相关的4 级成熟度(最高级)指标[9]。药品监管的透明度有助于提高监管效率、增强公众信任、促进企业合规、支持创新, 进而促进行业高质量发展。在药品检查方面的具体要求包括以下3 点。
(1)公开检查员信息。检查组到达被检查单位后,向被检查单位出示检查员证和检查通知。更好的做法是公开所有检查员的名单,被检查单位可以查询检查员的授权检查范围。
(2)履行告知义务。召开首次会议,告知检查要求;召开末次会议,通报检查情况,告知相应事项并听取意见。检查发现的问题需经检查组、被检查单位签字确认。
(3)建立信息公开渠道,制定信息公开管理制度。按要求发布并公开检查信息,包括被检查单位及监管决定等。
2、 药品检查机构的质量管理体系
2.1 关键评价系统
药品检查机构的质量管理体系是指,建立涵盖组织结构、程序、流程、资源和相关活动的体系。该体系涵盖了实施检查机构的质量方针和达到预定目标所必需的所有事项,以确保检查过程和结果满足质量要求。根据GRP 的合法性、一致性、独立性、公正性、均衡性、灵活性、清晰性、效率性和透明度九大原则,结合我国药品监管工作的实际情况,对药品检查机构质量管理体系的评价可以概括为11 大系统。表1 汇总了各评价系统与GRP 原则的对应关系。
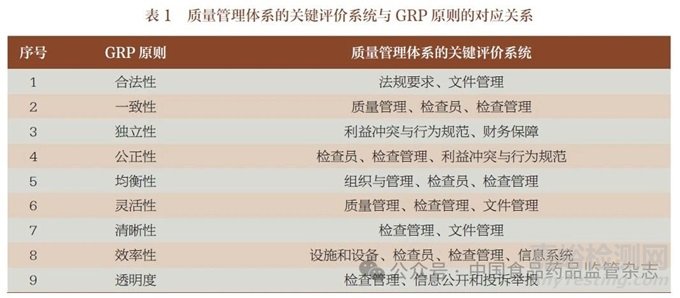
(1)法规要求。明确检查机构的设立、运行应符合法律要求,并有法律保障。开展检查工作应有上位法的依据,执行应有相关技术标准。
(2)质量管理。检查机构应建立质量管理体系,明确质量负责人、质量体系管理层级和运行机制,建立对检查工作的监督和评价机制,制定质量管理体系审核计划,有效执行质量管理体系,不断完善和持续改进检查工作,保证检查质量。
(3)组织与管理。检查机构应明确组织结构、机构职责、岗位职责等,机构负责人及部门负责人等关键人员应具备相关资质条件,保证机构职责的顺利履行。
(4)检查员。明确检查员分级分类、调派使用、教育培训、考核评价、廉洁自律、信息和证件等管理规则,推进职业化、专业化检查员队伍建设。明确检查员的能力要求和标准,保证人员能力符合检查工作要求。
(5)设施和设备。明确检查机构应具备的办公场所、设施、设备及相关管理制度,保证各项工作正常开展。
(6)文件管理。根据检查工作的上位法规、规范,制定相应的工作程序、技术指南等并及时更新,明确体系文件制修订、变更程序,明确规定各类文件格式和要求,有效保存文件和记录,便于追踪和检索。
(7)检查管理。明确检查过程各环节的要求,包括检查计划、检查方案的制定,检查员选派,检查报告撰写,时限控制等,保证检查工作按照规范的方法和工作程序执行。
(8)利益冲突与行为规范。明确机构应遵守工作要求、廉政要求、无利益冲突和保密要求,保证检查工作公平公正。
(9)信息系统。明确检查机构应实现检查业务和检查员信息化管理,遵循有关技术标准和要求,推进机构信息系统建设及数据共享。
(10)信息公开和投诉举报。明确检查机构应建立信息公开、投诉举报渠道,制定管理制度并规范执行。
(11)财务保障。明确检查机构应有经费保障,确保药品检查工作正常开展。
2.2 关键评价要素
PIC/S 对药品检查的评估体系有11个板块,共78个具体指标;WHO 对 NRA 的评估中,监督检查板块共有6 项涉及26 个指标,每个指标又分解为诸多评估要点。综合PIC/S 的指标和WHO 的评估要点,结合我国药品监管实际,将我国药品检查机构质量管理体系评估的11 大系统细分为96 个具体评价要素,见表2。

2.3 评价方法
PIC/S 对药品检查的评估有文件审查、现场评估、观摩检查共3 种评估方式[8]。结合我国药品检查机构工作实际,对质量管理体系的评估可采用PIC/S 的评估方式。表3 汇总了各评价系统的评价方法。其中,文件审查是指对检查机构制定的相关制度、程序、记录等文字材料进行审查,审查其是否符合上位法规、技术标准和上级部门的要求,是否对国家药监局的相关政策制定了具体的落实措施,可以通过现场查阅或远程调取的方式开展。现场评估是指对检查机构的人员、设施和设备、相关活动、原始记录和数据等进行进一步现场核实,评估其一致性、规范性、可追溯性。观摩检查是指在检查实施的现场同步开展的评估过程,是对检查工作特有的、高效的评估方法,既评估检查实施的规范性,又评估检查员的检查能力,可以对检查员和检查管理的整体表现和绩效作出评价。

3、 结语
2019 年新修订《药品管理法》实施以来,国家药监局陆续出台《药品生产监督管理办法》《医疗器械生产监督管理办法》《药物临床试验机构监督检查办法(试行)》《医疗器械临床试验机构监督检查办法(试行)》等文件,均要求国家相关检查机构对省级检查机构质量管理体系进行评估和指导。在推动全国药品检查“一盘棋”的大背景下,检查机构建立统一的质量管理体系迫在眉睫,而建立质量管理体系的评价体系对于指导质量管理体系的建立尤为重要。本文从分析GRP 原则在药品检查工作中的基本内涵入手,建立符合GRP 原则的评价要素,保证了质量管理体系评价体系的一致性。同时,评价要素保留了一定灵活性,不同的检查机构在实施过程中,可以对照要素,结合自身检查业务类型、组织架构、人员能力等具体情况因地制宜,制定具体的实施方法,具有更强的指导性。
2023 年国家药监局向PIC/S提交了正式加入的申请,意味着我国药品检查体系全面向国际标准看齐。建立统一的质量管理体系评价体系是国际监管共识,国家与省级、不同省级之间的检查体系一致性是PIC/S 评估最为重要的事项之一;WHO 先后6 次修订NRA 的评估工具,不断提高标准的统一性[10]。我国药品检查体系庞大而复杂,本文建立的评价体系完全转化了PIC/S 和WHO NRA 监督检查板块中的评估指标,为我国药品检查机构在建立和改进质量管理体系工作中提供参考借鉴,可进一步促进我国药品检查体系的统一,进而推动药品检查工作高质量发展。
引用本文
宋福鱼,曹轶*,安慧芬,江凡.WHO医疗产品良好监管规范要求及对我国药品检查机构质量管理体系评价的思考[J].中国食品药品监管.2024.12(251):38-45.

来源:中国食品药品监管杂志


