您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-05-21 11:39
|
药品注册核查相关法规一览表 |
||
|
发布时间 |
政策法规 |
发布单位 |
|
2008-05-23 |
《关于印发药品注册现场核查管理规定的通知》(国食药监注〔2008〕255号) |
SFDA |
|
2014-05-13 |
食品药品监管总局关于印发药品生产现场检查风险评定指导原则的通知(食药监药化监〔2014〕53号) |
CFDA |
|
2015-11-10 |
国家食品药品监督管理总局关于发布药物临床试验数据现场核查要点的公告(2015年第228号) |
CFDA |
|
2017-05-18 |
总局关于发布仿制药质量和疗效一致性评价研制现场核查指导原则等4个指导原则的通告(2017年第77号) |
CFDA |
|
2017-11-13 |
总局关于调整药品注册受理工作的公告(2017年第134号) |
CFDA |
|
2018-03-12 |
关于请企业在仿制药一致性评价品种受理时提交现场检查有关信息的函 |
CDE |
|
2018-04-02 |
关于公开征求仿制药一致性评价现场检查-企业指南(草案)意见的通知 |
CFDI |
|
2018-05-15 |
国家药品监督管理局关于加强化学仿制药注射剂注册申请现场检查工作的公告(2018年第20号) |
CFDI |
|
2018-12-28 |
关于开展化学仿制药注射剂注册生产现场检查有关事宜的通告(2018年第1号) |
CFDI |
|
2019-05-06 |
关于提交药品注册检查检验用申报资料光盘的通知 |
CDE |
|
2020-03-10 |
关于化药仿制药质量和疗效一致性评价注册申请开展药学研制和生产现场检查有关事项的通告(2020年第4号) |
CFDI |
|
2020-03-30 |
药品注册管理办法(2020年1月22日国家市场监督管理总局令第27号公布) |
NMPA |
|
2020-08-18 |
关于在申请人之窗提交药品注册核查检验用申报资料及查收启动核查通知书相关事宜的通知 |
CDE |
|
2021-12-20 |
关于发布《药品注册核查检验启动工作程序(试行)》的通告(2021年第54号) |
CDE |
|
2021-12-20 |
关于发布《药品注册核查工作程序(试行)》等5个文件的通告(2021年第30号) |
CFDI |
|
2021-12-30 |
关于药品注册申请人“确认”接受生产现场核查有关事宜的通告(2021年第31号) |
CFDI |
|
2022-01-29 |
关于调整部分地区发补通知及生产现场检查通知书、告知书送达形式的公告 |
CDE |
注释:SFDA和CFDA均为NMPA的前生。
|
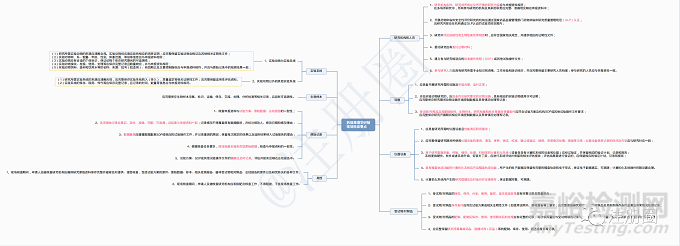
药理毒理学研究现场核查结果判定原则 |
||
|
经核查确认情况 |
归类 |
核查认定 |
|
1.编造或者无合理解释地修改实验系统信息以及试验数据、试验记录、受试物和对照品信息; |
数据造假 |
不通过 |
|
2.使用虚假受试物、对照品; |
试验用药品造假 |
|
|
3.隐瞒试验数据,无合理解释地弃用试验数据,或以其他方式违反试验方案选择性使用试验数据; |
选择数据 |
|
|
4.故意损毁、隐匿试验数据或者数据存储介质; |
瞒报数据 |
|
|
5.关键研究活动、数据无法溯源; |
无法溯源 |
|
|
6.申报资料与原始记录不一致且影响结果评价; |
不一致、不可靠 |
|
|
7.其他严重数据可靠性问题; |
||
|
8.拒绝、不配合核查,导致无法继续进行现场核查; |
不配合 |
|
|
9.法律法规规定的其他不应当通过的情形。 |
/ |
|
2、《药品注册核查要点与判定原则(药物临床试验)(试行)》



|
药物临床试验现场核查结果判定原则 |
||
|
经核查确认情况 |
归类 |
核查认定 |
|
1.编造或者无合理解释地修改受试者信息以及试验数据、试验记录、试验药物信息; |
数据造假 |
不通过 |
|
2.以参比制剂替代试验制剂、以试验制剂替代参比制剂或者以市场购买药品替代自行研制的试验用药品,以及以其他方式使用虚假试验用药品; |
试验用药品造假 |
|
|
3.隐瞒试验数据,无合理解释地弃用试验数据,以其他方式违反试验方案选择性使用试验数据; |
选择数据 |
|
|
4.瞒报可疑且非预期严重不良反应; |
瞒报数据 |
|
|
5.瞒报试验方案禁用的合并药物; |
||
|
6.故意损毁、隐匿临床试验数据或者数据存储介质; |
||
|
7.关键研究活动、数据无法溯源; |
无法溯源 |
|
|
8.申报资料与原始记录不一致且影响结果评价; |
不一致、不可靠 |
|
|
9.其他严重数据可靠性问题; |
||
|
10.拒绝、不配合核查,导致无法继续进行现场核查; |
不配合 |
|
|
11.法律法规规定的其他不应当通过的情形。 |
/ |
|
3、《药品注册核查要点与判定原则(药学研制和生产现场)(试行)》

|
药学研制现场核查结果判定原则 |
||
|
经核查确认情况 |
归类 |
核查认定 |
|
1.编造或者无合理解释地修改研究数据和记录; |
数据造假 |
不通过 |
|
2.以参比药物替代研制药物、以研制药物替代参比药物或者以市场购买药品替代自行研制的药物,或以其他方式使用虚假药物进行药学研究; |
试验用药品造假 |
|
|
3.隐瞒研制数据,无合理解释地弃用数据,或以其他方式选择性使用数据导致对药品质量评价产生影响; |
选择数据 |
|
|
4.故意损毁、隐匿研制数据或者数据存储介质等故意破坏研制数据真实性的情形; |
瞒报数据 |
|
|
5.与申报资料不一致且可能对药品质量评价影响较大; |
不一致 |
|
|
6.存在严重的数据可靠性问题,关键研究活动、数据缺少原始记录导致无法溯源,导致对药品安全性、有效性、质量可控性的评价产生影响; |
不可靠、无法溯源 |
|
|
7.拒绝、不配合核查,导致无法继续进行现场核查; |
不配合 |
|
|
8.法律法规规定的其他不应当通过的情形。 |
/ |
|

|
生产现场现场核查结果判定原则 |
||
|
经核查确认情况 |
归类 |
核查认定 |
|
1.存在严重偏离药品生产质量管理规范等相关法律法规,可能对产品质量带来严重风险的或者对使用者造成危害情形; |
偏离规定 |
不通过 |
|
2.编造生产和检验记录和数据; |
数据造假 |
|
|
3.隐瞒记录和数据,无合理解释地弃用记录和数据,或以其他方式选择性使用记录和数据导致对药品质量评价产生影响; |
选择数据 |
|
|
4.故意损毁、隐匿记录和数据或者其存储介质等故意破坏记录和数据真实性的情形; |
瞒报数据 |
|
|
5.无法证明能按照申报的上市商业化生产条件实现持续稳定生产; |
无法证实 |
|
|
6.存在严重的数据可靠性问题,关键数据和记录无法溯源,导致对药品质量的评价产生影响; |
不可靠、无法溯源 |
|
|
7.拒绝、不配合核查,导致无法继续进行现场核查; |
不配合 |
|
|
8.法律法规规定的其他不应当通过的情形。 |
/ |
|

来源:注册圈


