摘要
目的:对2020年新修订的《药品注册管理办法》颁布前后我国纳入药品加快上市注册程序并已批准上市的药品信息进行分析,为完善我国药品加快上市注册程序提供参考。
方法:检索国家药品监督管理局药品审评中心发布的2019-2021年度药品审评报告,对通过优先审评和药品加快上市注册程序而上市的相关药品数据资料进行信息整理和汇总分析。
结果:通过药品加快上市注册程序的上市药品数量逐年增多,优先审评审批资源向临床优势药品和创新药品倾斜。
结论:药品加快上市注册程序可为临床价值显著的药品提高审批效率,在一定程度上激发制药企业研制热情,但药品加快上市注册审批体系仍需进一步完善配套政策,细化实施要求,加快专业指南出台鼓励以临床价值为导向的药品的研发创制,不断提升药品监管部门的服务和监管能力。
随着我国药品审评审批制度改革的不断推进,对多元化的激励药品研发创制途径的需要日益迫切。2019年新修订的《药品管理法》中明确指出“支持以临床价值为导向的药物创新,推动药品技术进步”,2020年新修订的《药品注册管理办法》(以下简称《办法》)进一步提出“要建立并实施加快药品上市注册程序。”在新的法规框架下,加快上市注册申请覆盖了临床试验和上市许可的全过程,而更加细化的程序和要求有便于行业主体执行,推动药品创新,加快以临床价值为导向的药品的审评审批速度。本文以《办法》中药品加快上市注册程序为切入点,分析通过药品加快上市注册程序的上市药品数据信息,总结当前阶段我国药品加快审评审批政策落地实施情况,为完善我国药品加快上市注册程序以及推进以临床价值为导向的药品的创新提供建议和参考。
一、数据来源
通过查询国家药品监督管理局药品审评中心(Centerfor Drug Evaluation,CDE)网站2019-2021年的药品审评报告和信息公开栏,整理研究所用的药品申请、纳入和通过程序的件数(以注册申请件数计)以及药品品种个数(以通用名称计)等信息。主要根据2019年通过优先审评上市的药品数据,2020年纳入加快上市程序并已批准上市药品的数据以及2021年部分公开的通过程序并已批准上市的药品数据,并按照药品加快上市注册程序,对申请、纳入并通过上市的申请数量、药品类型以及重点治疗领域等方面进行数据处理和统计分析。
二、结果与分析
2.1 药品加快上市注册的程序路径分布总体情况
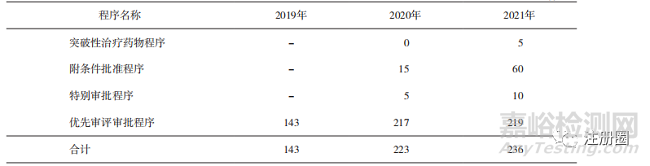
2019-2021年通过加快上市程序批准上市的申请数量持续增加,其中优先审评审批程序申请数量最多,突破性治疗药物程序申请数量最少(详见表1)。现有制度构建的加快上市途径对于促进临床价值突出和公共卫生急需等药品的上市具有明显推动作用。
▲ 表1-已批准上市纳入药品加快上市注册程序的数量统计 件
注:存在一个注册申请同时申请多个程序情况,合计值并非求和项。
2.2 突破性治疗药物程序申请注册情况
突破性治疗药物程序适用于通过早期临床研究数据发现具有突出临床优势,可以此缩短临床研发周期的药物。与国际上类似的药品加快上市注册程序相比,我国突破性治疗药物程序施行时间尚短,还处在探索阶段。2012年美国食品药品管理局(Food and Drug Administration,FDA)开始实施突破性治疗认定(Breakthrough Therapy Designation,BTD),欧洲药品管理局(European MedicinesAgency,EMA)在2016年实行了优先药物计划(Priority Medicines,PRIME)。
2.2.1 突破性治疗药物程序关注度较高
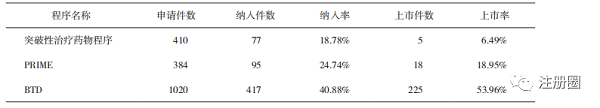
截至2021年12月31日,突破性治疗程序累计申请410件,CDE纳入77件突破性治疗药物申请,其中5件已批准上市。
对比截至2021年底FDA公布的BTD相关数据[1]以及EMA公布的PRIME相关数据[2],我国仅实施2年的突破性治疗药物程序申请总量比实施6年的PRIME申请总量还要多26件,是施行10年的BTD申请总量的40.20%(详见表2),证明《办法》实施后的政策获益对于我国制药企业具有较强的吸引和导向作用。
从审评时限看,与正常序列品种200日的常规上市许可申请的审评时限相比,从临床试验阶段申请纳入突破性治疗药物程序到批准上市仅在241~371日之间,可见突破性治疗药物从研发到上市的进程明显加快。
▲ 表2-我国突破性治疗药物程序、PRIME 和 BTD 的数量统计
2.2.2 突破性治疗药物程序的纳入率和上市批准率相对较低
我国突破性治疗程序的纳入率和上市批准率分别为18.78%和6.49%,明显低于美国和欧盟,说明相关申请的针对性较低,与政策的契合度有待提高。这与政策实施时间较短,政策的细化内容尚不深入有关,例如EMA细化了不同的研发阶段,包括早期临床和临床研发阶段的技术要求,我国仅明确了需提交的资料内容,对于企业早期临床研发缺乏指导作用;FDA则要求审评人员主动发现满足BTD的药物,同时强调有经验的审评人员参会以及除正式会议外要保持意见交换,推动BTD认证和加快上市,目前我国还没有类似的措施出台[3]。
2.3 附条件批准程序申请注册情况
附条件批准程序适用于尚未完成完整临床研究时,通过“先批准后验证”的形式加快具有突出临床价值的临床急需药品上市[4],旨在缩短药物临床研发时间,附“条件”尽快将优势产品推向市场。
2.3.1 附条件批准程序获益初显
截至2021年12月31日,已有75件注册申请附条件批准上市。与新药上市申请(New DrugApplication,NDA)数据对比来看,2020-2021年上市的NDA申请增长率为55.29%,附条件批准上市申请件数增长率为300%。经附条件批准的上市申请占NDA的比例也由2020年的7.21%增加至2021年的18.58%,增长速度明显加快且占比越来越高。
与同为新增快速上市途径的突破性治疗药物程序相比,附条件批准的上市申请数量明显较多,这主要因为附条件批准基于替代终点、中间临床终点或早期临床试验数据批准上市,上市周期更短,引发了行业的更大关注。
从重点治疗领域看,肿瘤治疗申请58件,占附条件批准程序申请的77.33%,新冠病毒疫苗申请8件,占已上市新冠病毒疫苗及其治疗药物(15件)的53.33%,附条件批准符合程序设计定位,有助于将医疗急需、临床价值显著的药品提前推向市场,获益初显。
2.3.2 附条件批准程序存在用药安全潜在风险
我国制度实施时间尚短,符合附条件批准程序的药物研发与技术审评都处于探索阶段。在已上市的75件附条件批准申请中,仅有5个品种转为正式批准[5],绝大多数申请还在上市后研究进程中。
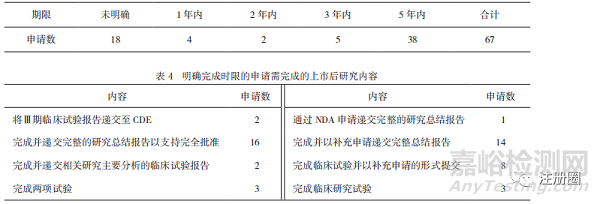
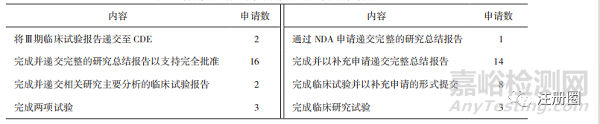
分析除新冠病毒疫苗和治疗药物外已公开的67份申请上市技术审评报告,其中在49件报告中,CDE明确了完成后续研究的期限和相关研究内(详见表3、表4)。未明确时限的上市申请仅写明了需要上市许可人完成的研究内容,少部分规定了与CDE沟通临床试验进展的时间,作为附“条件”上市的药品,上市后监管时限的缺失可能会导致公众临床用药安全问题出现。
▲ 表3-上市后要求完成期限
▲ 表4-明确完成时限的申请需完成的上市后研究内容
2.4 特别审批程序申请注册情况
特别审批程序是国家药品监督管理局依法将临床急需的保障公众生命健康的药品加速推向市场的程序设计,主要用于应对突发公共卫生事件。
2.4.1 特别审批程序主要集中于应急药品需求
截至2021年12月31日,共纳入特别审批程序140件,均为新冠病毒疫苗及其治疗药物,批准临床试验申请80件,批准上市申请15件,批准补充申请44件。
2.4.2 特别审评程序上市速度明显加快
相较于新药研发到上市一般需要10年以上的耗时,而我国获批上市的4款新冠病毒疫苗,在以统一指挥和早期介入为原则的特别审批程序运行下,仅用不到2年时间可实现从研发到上市。
2.5 优先审评审批程序申请注册情况
为解决药品注册申请积压问题,2015年国家启动药品审评审批改革,先后颁布了《总局关于解决药品注册申请积压实行优先审评审批的意见》和《总局关于鼓励药品创新实行优先审评审批的意见》,提出了优先审评并明确申请范围。2020年《办法》出台后,优先审评审批程序的申请范围和条件较前期政策有了明显变化,不再以治疗具体疾病纳入,剔除占用大量优先审评资源却未体现出临床价值和市场短缺的仿制药[6],优先审评资源更加凸显临床优势。
2.5.1 优先审评审批程序作用明显
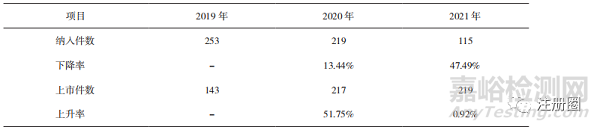
纳入优先审评审批程序的申请数量逐年减少且降幅明显加快(详见表5),获批上市的申请数量则逐年增加,表明监管部门优先审评资源投入更集中,提升了优先审评审批的效率,保障了临床优势药品和创新药品的尽快上市。
▲ 表5-2019-2021 年纳入和通过优先审评审批程序的申请数量及变化情况
2.5.2 纳入优先审评审批程序各类情形
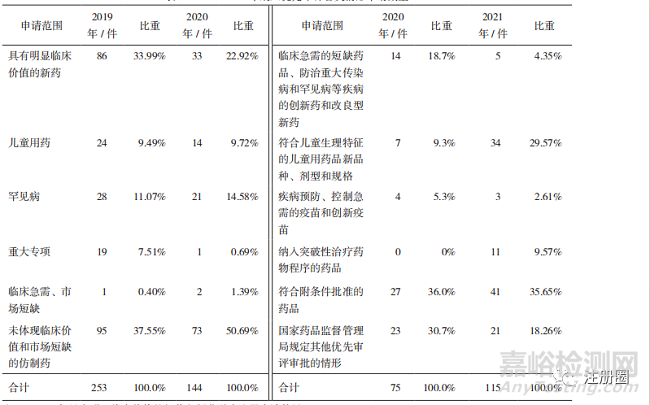
《办法》的实施,优先审评审批程序呈现缩口状态,政策红利向临床急需的用药倾斜,例如附条件批准程序药品、儿童用药、罕见病用药等,详见表6。
▲ 表6-2019-2021 年纳入优先审评各类情形申请数量
注:1. 2020 年具有明显临床价值的新药包括艾滋病注册申请数量。
2. 未体现临床价值和市场短缺的仿制药包括同步申报、按与原研药质量和疗效一致的标准完善后重新申报、专利到期和首仿药品。
2.6 药品加快上市注册程序的药品类型分布
根据《办法》对于药品注册管理的分类,将药品分为中药、化学药品和生物制品3个类型进行统计分析。
2.6.1 各类型药品加快上市注册的总体情况
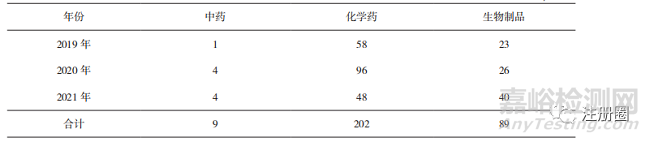
通过药品加速上市注册程序的化学药品数量最多,生物制品次之,中药品种数量最少(详见表7),这和常规审评上市注册情况一致。生物制品作为未来制药行业的创新热点领域,纳入并通过药品加快上市注册程序的数量不断增加。
▲ 表7-2019-2021 年通过药品加快上市注册程序不同药品类别上市品种数量 个
2.6.2 各类型药品加快上市注册的比较分析
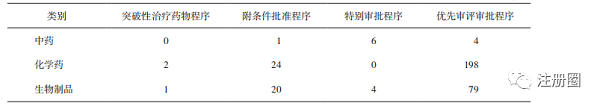
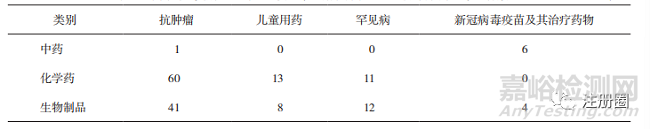
中药品种以特别审批程序为主(详见表8),以清肺排毒颗粒、化湿败毒颗粒和宣肺败毒颗粒为经典名方代表的审评实践,加快了中药上市的进程,“三方”的获批上市是中药监管科学发展的一个标志性成果[7],也充分发挥了中药品种对于新冠病毒的治疗优势。除新冠治疗药物外,仅有1个肿瘤治疗药物,儿童用药等中药传统优势病种的相关申请相对不足(详见表9)。
▲ 表8-中药、化学药及生物制品通过四种途径的上市品种数量 个
▲ 表9-不同药品类别通过药品加快上市注册程序在重点治疗领域的上市品种数量 个
化学药品和生物制品以优先审评审批程序为主,这是因为与作为鼓励真正的创新药投入临床使用的突破性治疗药物程序和附条件批准程序相比,优先审评审批程序政策纳入口径相对宽泛,申请难度相对较小。在重点治疗领域,二者在儿童用药、罕见病治疗等方面数量相当,而在肿瘤治疗方面,尽管化学药品在数量上比生物制品多,但增长速度上生物制品超过了化学药品,这与生物制品相关的生物治疗是继手术、放疗和化疗之后的第四代肿瘤治疗方法[8]相关,但有研究表明,境内生产的生物制品中自主研发的1类创新药比重低,且像PD-1单抗的研发扎堆明显,与国际先进水平还有一定差距[9]。
三、讨论
药品加快上市注册程序弥补了我国从药物研发到上市监管的全生命周期覆盖制度设计的缺失,以临床价值为导向注重药物创新,缩短药物研发时间,提高审评效率,政策实施取得了阶段性效果。一方面,优先配置审评资源,与药品监管部门进行沟通以及缩短审评时限加速上市等政策获益,激发企业研发热情,提高创制质量;另一方面,药品可以更快投入临床应用,增加治疗选择,保障公众用药可及性。
但由于《办法》出台时间短,新旧政策交替过渡,药品加快上市注册程序实施还在探索阶段。帮助企业突破技术壁垒、加快研发成果转化、加快审评制度改革完善、提供切实对企业创新形成激励作用的政策红利等需要药品监管部门重点关注。
3.1 药品加快上市注册程序相关制度有待进一步完善
从出台的药品加快上市注册程序配套文件来看,缺乏原则性政策的具体操作文件,没有形成通用性指南,不能很好地指导企业执行政策,甚至会导致审评效率低下。在《办法》中仅涉及了特别审批程序的原则性表述,并未更新工作程序和技术指导,附条件批准程序也尚未出台上市后监管具体要求。对比国际先进做法,审评人员在临床急需用药上市注册中主导作用发挥不充分,审评资源利用不充分、不高效。
3.2 药品创新激励有待进一步加强
我国原创性新药数量相对少,国产创新药处在重要转型期,国内药品领域存在过于激烈的同质化竞争,上市产品差异化不明显[10]。药品加快上市注册程序作为我国药品加速审批路径,注重纳入和上市注册药品的临床价值和创新性,但目前来看,药品临床优势疗效较药品的创新性在4种加速途径中占比更多。
四、建议
4.1 持续完善药品加快上市注册程序制度改革
4.1.1 加快专业技术指南出台
现有加快上市注册制度的构建是为了解决临床急需用药问题。对比常规审批上市注册药物,通过药品加快上市注册程序上市的药品临床研发难度大,临床设计方案难点多。建议尽快出台能够作为通用规范的技术指南,如药学通用技术指南,提供充足的技术保障,以服务于药学研究与技术审评[11]。总结审评经验和不同适应证特点,考虑药物本身创新程度及作用机制,规范临床试验设计方案,内容方面可以涉及用于不同研究的合理样本量,在无法满足样本数时建议采用的研究方法及资料完整度要求等,减少企业因临床设计方案缺陷导致纳入程序批准上市失败。
4.1.2 推进相关配套政策完善
政策文件需要贴合当前环境发展以及事物本身发展规律。建议药品监管部门尽快更新特别审批程序的工作程序,补充申报资料要求,明确沟通机制,建立退出和终止程序,设置滚动提交审评资料以充分体现审评前置作用,授予应急情况下的赔偿责任豁免权,加快应对重大公共卫生事件的药品上市,使得特别审批更具可操作性;出台附条件批准上市后监管法规文件,针对药品研发特点,合理明确上市后确证性研究期限时长和规范化审评标准,以完整上市后审评路径;不断开发符合中药特点的审批制度,如《中药注册管理专门规定》的出台可以帮助企业厘清中药研发的思路,从制度设计上提高中药审评审批效率。在未来政策完善过程中应尊重中药品种发展规律,建议可依据实际情况来看待药效学研究。同时,中药新药研发要避免只关注重大疾病,应聚焦常见病、多发病,充分发挥中药临床优势。
4.1.3 细化政策实施原则性要求
建议药品监管部门可借鉴国际加快药品上市制度的先进做法,针对不同研发阶段提出不同技术的具体要求,定期发布建议的临床替代终点指标用于企业研发参考[12],加快我国技术指导体系与国际通行规则接轨,更好地发挥突破性治疗药物程序和附条件批准药物程序在药品上市注册中前端和中端的加速作用,从临床研发早期给予优先审评资源,在一定程度上确保企业提出满足监管和药品安全有效的临床研究策略,提高新药研发成功率,尽快批准临床优势产品上市。
4.2 加强药品监管部门服务和能力建设
在确保药品安全性和有效性的前提下,加强审评队伍建设和条件建设,改善药品监管部门与申请人的互动交流效果,提升审评审批效率[13]。建议药品监管部门不断推进人员队伍建设,适当扩容审评人员数量,合理配置人员工作内容,积极跟进临床急需用药上市注册情况。开展专业知识培训并予以考核验收成果,强化人员队伍专业知识能力、审批工作完成能力以及药品审评全流程监管核查能力。同时,更好地引导药品研发企业正确认识制度要求,把握政策改革内涵,激发市场主体活力。
加快药品上市注册程序的实施效果初显,审评标准也在进一步探索发展。建议规范技术审评尺度,形成制度化行业共识,结合技术指南建设,不断在实践中清晰审评要求,提升药品审评服务和监管能力,落实政府“放管服”工作原则。
4.3 激励企业加快临床价值药品研发创制
新增加的突破性治疗药物程序和附条件批准程序,作为鼓励真正的创新药品投入临床使用,而非“mebetter”“mebest”药品。药品研发创新不能仅在现有靶点上开发新的适应证,建议加强原创基础研究,强化数字医疗在医药领域研究应用,研制创新所需大型设备[14],构建企业、高校与医院等多方知识交流平台,突破研发技术壁垒和研制药品新靶点。建议完善同情用药制度,明确主体参与条件责任并加强药品风险管理细化实施条件,弥补创新药研发设计上可能存在的现实问题,配合药品加快上市注册程序,确保研究成果落地,产出具有国际影响力的原创性新药。
药品研发生产企业是药品领域重要的参与主体,建议药品监管部门积极寻求行业对话,建立制药行业政府机构和专家委员会的对话机制,就行业技术指南、政策实施效果反馈以及亟待解决领域问题等定期进行意见交换,激发企业主动作为。同时,药品监管部门及时把握行业动态,予以政策扶持,建议同靶点首家国产创新药可酌情加快审评审批[15]。
当前肿瘤治疗药品热度过高,存在创新药靶点研究重复度高的现象,建议与新药研发专利制度以及儿童用药市场独占权等形成政策链接,鼓励企业适当开发肿瘤治疗药物以外的其他领域药品。
参考文献
[1] FDA. Breakthrough Therapy Designation Requests[EB/OL].(2023-01-12)[2023-03-16]. https://www.fda.gov/drugs/ind-activity/breakthrough-therapy-designation requests.
[2] EMA. PRIME:Analysis of the First 5 Years’ Experience[EB/OL].(2022-03-03)[2023-03-16].https://www.ema.europa.eu/en/documents/report/prime analysis-first-5-years-experience_en.pdf.
[3] 袁利佳,汪小燕,杨志敏,等. 突破性治疗药物程序在药品注册体系中的作用及展望[J]. 中国药事,2022,36(9):973-983.
[4] 唐辉,汤立达. 药品附条件批准上市的内涵与风险防控[J]. 中国医药导刊,2021,23(4):289-295.
[5] 袁利佳,陈小明,张宁. 我国药品附条件批准程序实施情况及相关思考[J]. 中国药事,2022,36(10):1093-1102.
[6] 吴忠虹,董丽. 我国药品优先审评审批制度的现状分析[J]. 中国处方药,2022,20(10):29-31.
[7] 黄明,杨丰文,张俊华,等. 新时代中药传承创新发展呼唤科学监管[J]. 中国中药杂志,2023,48(1):1-4.
[8] 谢华玲,陈芳,Cynthia,等. 全球生物制药领域研发态势分析[J]. 中国生物工程杂志,2019,39(5):1-10.
[9] 辛中帅,张辉,杨建红,等. 我国已上市治疗用生物制品问题分析及监管建议[J]. 中国药事,2019,33(9):982-985.
[10] 杜逸航,孙友松,陈倩,等. 2021年全球获批上市的原创新药:回顾与展望[J]. 中国新药杂志,2022,31(11):1033-1041.
[11] 赵一飞,耿欣,徐立华,等. 对我国附条件批准上市化药药学技术要求的思考[J]. 中国药科大学学报,2021,52(5):636-642.
[12] FDA. Table of Surrogate Endpoints That Were the Basis of Drug Approval or Licensure[EB/OL].(2022-02-28)[2023-03-16].
https://www.fda.gov/drugs/development resources/table-surrogate-endpoints-were-basis-drug approval-or-licensure.
[13] 姚立新,李茂忠,董江萍,等. 从PDUFAⅠ到PDUFAV——FDA通过法规体系的完善实现新药审评的持续改进[J]. 中国新药杂志,2013,22(10):1143-1156,1169.
[14] 陈丽湘. 加快中医药振兴发展推动中药新药尽早上市[N]. 证券时报,2022-03-10(A04).
[15] 马立敏,汪祥波. 深化中药审评审批改革加快中药新药研发[N]. 南方日报,2022-03-11(A06).