今日头条
锐康迪皮质醇合成抑制剂拟纳入优先审评。Recordati集团旗下锐康迪医药新型皮质醇合成抑制剂磷酸奥西卓司他薄膜衣片(Isturisa)获CDE拟纳入优先审评,用于治疗成人内源性库欣综合征(CS,内源性皮质醇增多症)。Isturisa通过抑制11-β羟化酶发挥作用,抑制皮质醇过量产生,以恢复患者的皮质醇正常水平。今年8月,该新药已获批落地乐城博鳌超级医院,为中国CS患者提前带来新的治疗选择。
国内药讯
1.迈威自研“升白”新药III期临床积极。迈威生物注射用重组(酵母分泌型)人血清白蛋白-人粒细胞集落刺激因子融合蛋白8MW0511联合化疗治疗乳腺癌的III期研究积极结果将在ESCO大会上公布。在第1-4化疗周期中,8MW0511与津优力®两组4级中性粒细胞减少的持续时间(DSN)的统计达到非劣效性;8MW0511组4级中性粒细胞减少的发生率均低于对照组(16.5% vs 19.5%、3.0% vs 9.8%、2.7% vs 6.7%、3.4% vs 6.1%)。此外,药物具有良好的安全性。
2.奥赛康CLDN18.2单抗获批胃癌Ⅲ期临床。奥赛康子公司AskGene靶向CLDN18.2的单抗药物ASKB589注射液获国家药监局批准开展Ⅲ期临床,联合CAPOX(奥沙利铂和卡培他滨)及PD-1抑制剂,评估用于一线治疗CLDN18.2阳性的局部晚期、复发性或转移性胃及食管胃交界处腺癌患者的有效性和安全性。在Ⅱ期扩组研究中,经研究者确认,ASKB589联合CAPOX治疗在这类胃癌患者中达到79.2%的客观缓解率(cORR),疾病控制率(DCR)达95.8%。
3.礼来非共价BTK抑制剂拟纳入优先审评。礼来新一代非共价布鲁顿氏酪氨酸激酶(BTK)抑制剂Pirtobrutinib片获CDE拟纳入优先审评,单药用于治疗复发或难治性套细胞淋巴瘤(MCL)经治患者。在Ⅰ/Ⅱ期BRUIN临床中,pirtobrutinib在这类难治性患者中达到50%的缓解率,分别有13%与38%的患者达成完全与部分缓解。今年1月,FDA已加速批准Pirtobrutinib(Jaypirca)上市,是首个针对BTK抗性癌症的BTK抑制剂。
4.先声PD-L1/IL-15双抗获批膀胱癌临床。先声药业旗下先声再明自主研发的抗PD-L1/IL-15双功能融合蛋白注射用SIM0237获国家药监局批准新的临床许可,拟用于非肌层浸润性膀胱癌(NMIBC)的治疗。SIM0237旨在通过解除免疫抑制和激活免疫系统的双重协同作用来发挥抗肿瘤作用。目前,该新药正在中美两国同步开展用于晚期实体瘤治疗的I期临床研究。
5.恒瑞PD-1组合肝癌适应症海外授权。恒瑞医药宣布已与美国Elevar公司达成合作协议,授予Elevar公司在除大中华区和韩国以外的全球开发和商业化PD-1抑制剂卡瑞利珠单抗联合阿帕替尼治疗肝细胞癌的独家权利。2023年1月,卡瑞利珠单抗联合阿帕替尼已在中国获批用于一线治疗晚期肝细胞癌患者。根据协议,恒瑞将有可能获得累计6亿美元的销售里程碑款,以及超过一定累计净销售额后的额外付款。
国际药讯
1.默沙东K药获批治疗早期肺癌。默沙东PD-1抑制剂Keytruda获FDA批准新适应症,与含铂化疗联用作为手术前新辅助治疗,并在手术后单药作为辅助治疗,用于治疗可切除的非小细胞肺癌(NSCLC)患者。在Ⅲ期KEYNOTE-671试验中,Keytruda的治疗方案将疾病复发、进展或死亡风险降低42%(HR=0.58 ;p=<0.00001)。此外,欧盟委员会(EC)也于近期批准Keytruda用于单药辅助治疗接受完全切除和含铂化疗后有高风险复发的NSCLC患者。
2.百时美施贵宝O药获批辅助治疗黑色素瘤。百时美施贵宝PD-1抑制剂Opdivo(nivolumab)获FDA批准新适应症,辅助治疗完全切除的IIB或IIC期黑色素瘤患者(≥12岁)。在Ⅲ期临床(CheckMate-76K)中,与安慰剂相比,Opdivo降低患者58%的复发或死亡风险(HR:0.42,95% CI:0.30-0.59,p<0.0001);两组12个月无复发生存率分别为89%(95% CI:86-92)与79%(95% CI:74-84);临床中未发现新的药物安全性问题。
3.免疫细胞因子疗法III期临床积极。太阳制药与Philogen开发的免疫细胞因子疗法daromun(Nidlegy)新辅助治疗局部晚期完全切除黑色素瘤的III期Pivotal研究达到主要终点。daromun可将IL-2和TNF聚集在肿瘤组织,保证疗效并最小化全身毒性。中位随访为27.6个月时,经盲法独立中央审查(BICR)和研究者评估的无复发生存期(RFS)改善均具有统计学意义,使复发风险降低33%和37%;药物治疗相关不良事件(TRAE)可控。
4.阿斯利康EGFR-TKI肺癌sNDA获优先审评。阿斯利康第三代EGFR抑制剂Tagrisso(osimertinib,奥希替尼)补充新药申请(sNDA)获FDA授予优先审评资格,联合化疗用于治疗局部晚期或转移性EGFR突变、非小细胞肺癌(NSCLC)患者。在Ⅲ期FLAURA2临床中,与奥希替尼单药相比,研究者和BICR评估的奥希替尼联合化疗将患者中位PFS分别延长8.8个月和9.5个月。此前,该新药针对NSCLC患者已获批三项适应症。
5.H3R拮抗剂特发性睡眠增多III期临床失败。Harmony Biosciences公司H3R拮抗剂/反向激动剂pitolisant(替洛利生)治疗特发性睡眠增多(IH)的III期INTUNE研究未达到主要终点。与安慰剂相比,pitolisan治疗8周后患者嗜睡量表( ESS )评分的改善不具统计学意义;治疗组实现ESS值下降≥3分的患者比例约为83%;药物的安全性与既往研究一致,没有发现新的安全性信号。琅铧医药拥有该新药的中国权益。
6.诺和诺德13亿美元购进创新高血压新药。诺和诺德拟以高达13亿美元收购KBP Biosciences公司临床后期小分子非甾体盐皮质激素受体拮抗剂(nsMRA)Ocedurenone,开发应用于高血压等心血管和肾脏疾病的治疗。此项收购预计在今年年底前完成。Ocedurenone已在用于治疗高血压和晚期慢性肾病(CKD)的Ⅲ期临床(CLARION-CKD)中达到主要终点,在治疗第84天时,患者的收缩压(SBP)较基线显著改善。
医药热点
1.深圳光明区新增一家三甲医院。近日,中国科学院大学深圳医院(光明)新院项目感染楼主体结构封顶,该项目正处于主体结构封顶的冲刺阶段。中国科学院大学深圳医院(光明)新院位于光明区公明北环大道与富利路交会处东南侧,北临公明北环大道,西临富利路,拟建三级甲等综合性公立医院,用地面积5万平方米,总建筑面积33.7万平方米。该项目是深圳市重点项目之一,建成后将提供床位1500个。
2.国家儿童“双中心”管理委员会成立。10月12日,国家儿童医学中心和国家儿童区域医疗中心管理委员会成立大会暨双中心委员会第一次会议召开。大会审议并通过双中心委员会主任委员和委员名单,以及双中心委员会章程。双中心委员会设主任委员3名,分别由首都医科大学附属北京儿童医院、复旦大学附属儿科医院、上海交通大学医学院附属上海儿童医学中心主要负责人担任;设委员6名,分别由国家儿童区域医疗中心主要负责人担任。
3.福建中医药大学换帅。10月16日,福建中医药大学在官微发布中共福建省委关于有关领导同志任职的决定。任命林生同志为中共福建中医药大学委员会委员、常委、书记。根据公开信息,林生,男,汉族,中共党员,工程硕士,研究员,硕士生导师。2022年2月起任福建省委教育工委副书记、省教育厅党组成员。2023年10月起任福建中医药大学党委书记。
评审动态
1. CDE新药受理情况(10月17日)
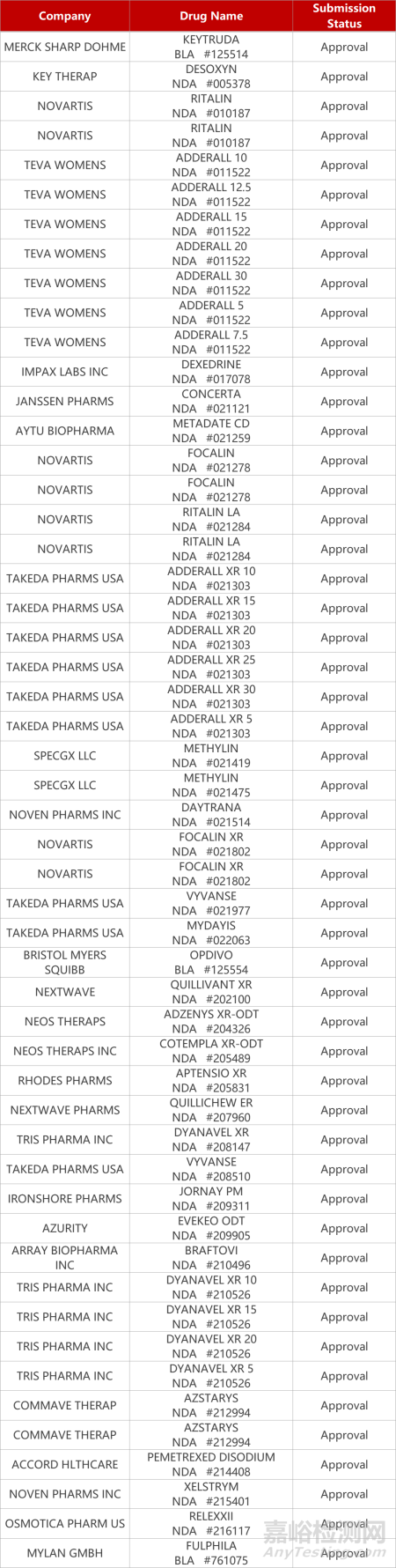
2. FDA新药获批情况(北美10月16日)