室性心律失常是美国心脏性猝死的主要原因。目前的起搏方式不足以预防或治疗这些瘢痕或其他病变心肌导致的心脏组织电传导减慢。随之而来的空间和时间异质性会导致断波、再入、混乱的心脏活动和颤动。目前的治疗方法主要是联合使用抗心律失常药物--所有这些药物都有很高的毒性--和/或对病变区域邻近或附近的组织进行消融和破坏。抗心律失常药物的作用是进一步减慢传导速度,以彻底消除这种传导。这也正是它们助长心律失常的原因:降低传导速度是再入室诱发和维持再入室的必要条件。尽管消融策略被广泛采用,但其失败率很高,18%-40% 的病例会出现复发性心律失常。最重要的是,这些技术都不能纠正再入的基本机制:延迟传导。对许多患者来说,目前唯一的选择是植入式心脏除颤器,它使用高能量电击来扑灭再入电信号。这些冲击远远超过了疼痛阈值,对生活质量的负面影响也十分明显,包括创伤后应激障碍和抑郁症。针对再入路的潜在病理生理学的预防性治疗方案仍然遥遥无期。室性心律失常是导致心脏性猝死的主要原因,临床上迫切需要一种能从根本上解决室性心律失常病理生理学问题的治疗方案。
来自美国德克萨斯心脏研究所和美国贝勒医学院的Mehdi Razavi团队与来自美国得克萨斯大学奥斯汀分校的Elizabeth Cosgriff-Hernandez(Materials Advances副主编)合作开发了可注射水凝胶电极技术以及在猪模型中的成功应用,其接入方式比目前任何起搏方式都要精细得多。除了成功的心脏捕获和起搏外,对表面心电图描记和三维电解剖图的分析表明,QRS 形态与原生窦性心律相当,这强烈表明水凝胶电极捕获了deep septal bundle branches和浦肯野纤维。在消融模型中,电解剖绘图数据表明,水凝胶的激活波前到达心肌中层和心内膜的时间比目前的单点起搏模式要早得多。这种对大片组织的均匀激活可最大限度地减少异质组织的心肌传导延迟,而这种延迟正是再入路的基础。总之,本研究证明了一种新起搏模式的可行性,这种模式最接近于原生传导,有可能消除致命性再入性心律失常,并提供无痛除颤。相关工作以题为“Injectable hydrogel electrodes as conduction highways to restore native pacing”的文章发表在2024年1月2日的国际顶级期刊《Nature Communications》。
1. 创新型研究内容
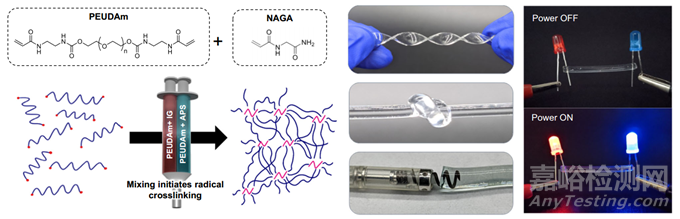
本研究开发了一种可注射的水凝胶电极,它能填充心外膜冠状静脉和支流,将其转化为柔性电极,最终到达迄今为止无法到达的心肌中层。这种方法利用了微创导管输送和标准起搏器技术的优势,可融入临床工作流程并确保被采用。除了增加进入心肌中层的机会外,这种水凝胶电极还能沿电极长度从多个部位同时起搏,而不是单点刺激。本研究假设,由此产生的来自电极长度的平面波传播将刺激心室组织的广泛区域,否则这些区域将受到延迟激活的影响。这将使作为再入基础的延迟激活区域正常化并消除。为此,本研究开发了一种水凝胶系统,它具有必要的导电性、生物稳定性和快速原位固化,可通过经静脉导管输送。
【具有快速原位固化和离子导电性的可注射水凝胶】
目前还没有一种水凝胶能满足心脏电极向心肌中层进行血管内输送的多方面需求:可注射性、导电性和生物稳定性。聚乙二醇(PEG)水凝胶具有公认的生物相容性和高度可调的软组织特性,是一种很受欢迎的选择;但是,传统的丙烯酸酯衍生 PEG 水凝胶容易因水解而在体内缓慢降解。为了生成适合长期植入应用的 PEG 基水凝胶,本研究合成了一种兼具生物稳定性、柔韧性和耐久性的水凝胶化学成分。聚醚聚氨酯二丙烯酰胺(PEUDAm)含有聚氨酯和酰胺基团,在生理条件下可抗水解(图 1)。H1 NMR 证实了成功的转化率(>95%)。除了生物稳定的 PEG 大分子外,本研究还合成了 N-丙烯酰基甘氨酰胺(NAGA),这是一种具有双叉氢键的小分子交联剂。本研究提出的设计还要求在没有外部刺激(如紫外线)的情况下快速原位固化水凝胶。本研究团队的实验室以前曾利用过硫酸铵(APS)和葡萄糖酸铁(IG)这对氧化还原剂展示过可调凝胶。本研究使用带混合头的双管注射器输送前体溶液,作为将来从双腔导管输送的类似物。迭代测试确定了小于 1 分钟的目标固化速度,在小于 2 分钟的时间内完全形成网络,这相当于 APS 浓度≥0.75 mM。离子 PEUDAm 水凝胶依靠溶解在前驱体溶液中的盐作为电荷载体,在连接到电源时产生电流。
图1 设计可注射水凝胶电极
【注射式水凝胶电极在猪模型中的成功应用和安全性】
为了模拟临床上在跳动和灌注心脏中的应用,本研究使用猪模型将前体溶液注入前静脉,并对静脉和支流中的体内凝胶形成和保留进行了表征(图 2A)。取出的水凝胶在整个水凝胶长度上(近端到远端)显示出极好的节段均匀性,平衡膨胀比和凝胶分数的差异极小。需要注意的是,计算出的凝胶分数并没有考虑从注射到外植之间凝胶的任何潜在浸出。平衡溶胀比可以衡量水凝胶网络结构,并表明凝胶的形成在整个静脉长度上是均匀的(图 2B)。一旦将水凝胶注入静脉并连接到起搏装置,它将在患者的有生之年留在该位置。
本研究进行了初步的安全性评估,以确认静脉闭塞不会对动物造成急性不良影响,并评估宿主对凝胶的反应。与动脉介入不同,以静脉血管为目标具有几个优势:1)闭塞的临床耐受性良好,不会发生缺血事件;2)血管没有重塑,可以稳定放置;3)静脉压力低(舒张期<10 mmHg,收缩期<30 mmHg),不太可能使水凝胶脱落,这一点已在本研究中得到证实。在临床环境中,水凝胶将通过导管输送到静脉;但是,在这项初步可行性研究中,为了进入静脉并输送水凝胶,需要进行心外膜切口。在这种特殊情况下,水凝胶被注入前室内静脉(AIV)并保留四周(n = 3),注入心脏中静脉(MCV)并保留两周(n = 1)。分别在两周和四周(图 2C)后切除并分析注射部位近端、邻近和远端的组织切片,以评估心脏损伤和炎症的程度。组织病理学上没有心肌坏死的证据,也没有左心室心肌损伤的证据。所有部位都观察到轻度血管周围和间质纤维化,慢性心外膜炎更靠近切口/注射部位(图 2C)。
图2 猪模型冠状静脉注射电极的体内评估
【水凝胶电极通过捕捉心肌中层组织模拟生理传导】
开发可注射水凝胶电极的基本假设是,它应能从心脏静脉进行心脏起搏。本研究设计的水凝胶电极的临床工作流程包括:使用双腔导管输送水凝胶前体溶液,填充冠状静脉和支流,这些静脉和支流横跨瘢痕组织附近的心肌,氧化还原引发的交联使离子水凝胶快速固化(图 3A);随后将起搏器导线连接到离子水凝胶电极,增加了整个心肌的组织接触(图 3B);沿着水凝胶电极的心肌波前激活减少了除颤所需的能量(图 3C)。本研究在猪模型中测试了注射式水凝胶电极,以模拟临床应用。在脉冲宽度为 5 毫秒时,测得金属电极的单极起搏阈值为 2.2 ± 1.2 毫安,2.3 ± 0.6 毫安,心外膜水凝胶点源(0.8 厘米圆盘)为 1.5 ± 1.28 毫安,心外膜水凝胶为 1.5 ± 1.3 毫安,AIV 中的水凝胶为 2.7 ± 1.8 毫安。在 5 毫秒和 10 毫秒脉宽时,不同电极配置的捕获阈值没有明显差异。在其他脉宽下测量的起搏阈值详见。双向方差分析显示,只有脉宽小于或等于 1 毫秒时的捕获阈值存在显著差异。使用金属电极、水凝胶点或水凝胶线进行心外膜起搏会产生倒置的 QRS 形态,表明偏离正常传导(图 3D)。
图3 可注射水凝胶系统示意图:将冠状静脉转化为可捕捉无法触及的心脏组织的柔性电极
【通过水凝胶电极起搏可使异质心肌的组织激活正常化】
本研究利用猪消融模型脉冲传播的电解剖图研究了点源起搏和水凝胶电极对异质组织传导的影响。简言之,在猪心靠近AIV的心外膜上进行消融,以破坏原生传导并模拟瘢痕心肌的情况。图 4A 利用尸体解剖显示消融后瘢痕形成的深度。点起搏显示消融后出现延迟和异质(局灶)激活波前,这归因于消融病灶的形成(图 4B)。如上所述,在 AIV 中注入并固化了水凝胶,随后的电压绘图证实水凝胶电极增加了组织激活面积(图 4C)。此外,电解剖图首次表明,在消融模型中,水凝胶的激活波前到达心肌中层和心内膜的时间比点起搏要早得多。第二个关键观察结果是,在 AIV 水凝胶起搏中,心肌中层和心内膜观察到了广泛的早期激活。
图4 猪消融模型中的心脏电解剖图研究
2. 总结与展望
在大型动物模型中使用这些可注射水凝胶电极进行的心脏起搏研究证明了这种方法的有效性。虽然本研究没有评估这种起搏在病变心肌中的效果,但本研究证明了利用当前的商业技术直接对这些过去无法接近的心脏区域进行起搏的能力。支持这一点的证据是,起搏后的表面心电图形态与原始心电图形态几乎完全相同。在室间隔深度起搏的临床报告中也观察到类似的 QRS 向量正常化效果。
此外,起搏刺激与表面心电图启动之间存在明显的延迟。这是因为起搏输出在进入心肌组织之前,至少有一部分是通过本地传导系统捕获和传导的。因此,起搏刺激与心电图信号开始之间存在延迟。这些特征都是可重复观察到的,强烈暗示了直接捕获心肌中层组织,而这在技术上一直是个难题,据本研究团队所知也从未有过报道。
继这一令人振奋的发现之后,本研究又测试了本研究的核心假设,即同时刺激大面积的心室组织可减少组织异质性(如瘢痕)的影响,而组织异质性会导致心电传导延迟。目前正在开发一种室性心律失常发病率较高的猪心肌梗塞模型,以全面评估拟议技术的临床益处。为了对组织异质性对传导的影响进行概念验证评估,本研究在普遍接受的消融模型中比较了点电极起搏和水凝胶电极起搏。电解剖图清楚地显示了点起搏消融后的传导延迟,水凝胶电极显著增加了激活面积,从而解决了传导延迟问题。虽然该模型并不能完全复制心肌梗死后瘢痕的影响,但它确实证明了水凝胶电极能显示出更快的传导速度,并至少在有限的心肌损伤区域将组织异质性对传导速度的影响降至最低。鉴于组织异质性与室性心律失常之间的基本联系已得到证实,水凝胶电极已证明有可能终止远低于疼痛阈值的再入。无痛除颤和潜在的心律失常预防方法将彻底改变心律管理方式。
文章来源:
https://doi.org/10.1038/s41467-023-44419-0
https://www.163.com/dy/article/I25O7VHV0552GRMJ.html