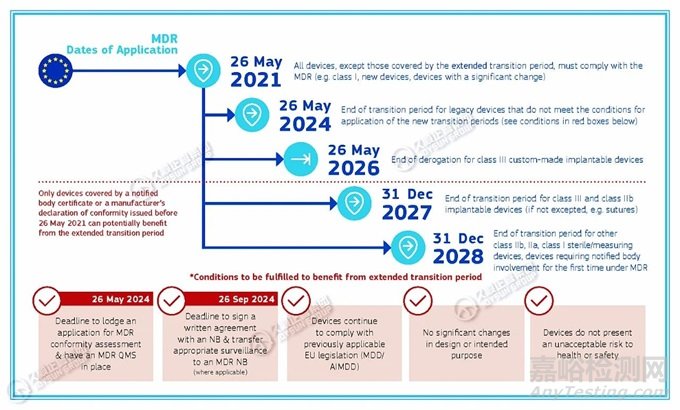
时间仅剩3个月! 2024年5月26日前,遗留器械应当提交MDR符合性评估申请并建立质量管理体系,否则无法享受过渡期延长。
MDR法规过渡期延长的时间要求
欧盟《MDR过渡期时间表》提出:2024年5月26日,不满足新过渡期应用条件的遗留器械的过渡期结束;
从过渡期延长中受益所需满足的条件有:
· 2024年5月26日:提交MDR符合性评估申请并建立MDR质量管理体系的截止日期;
· 2024年9月26日:与公告机构签署书面协议并将适当的监督转移至MDR公告机构(如适用)的截止日期;
· 器械继续遵守先前适用的欧盟法规(MDD/ AIMDD);
· 设计或预期目的无重大变化;
· 器械不会对健康或安全构成不可接受的风险。
遗留器械的定义
· 在2021年5月26日前,MDD指令下的I类医疗器械已拟订符合性声明,MDR法规下其符合性评估程序需要公告机构参与的;
· 在2021年5月26日前,按照MDD指令或AIMDD指令已取得CE标志。
MDR法规对质量管理体系的要求
按照MDR要求,制造商需要基于MDR要求建立、运行并保持质量管理体系。
2024年5月26日前,所有遗留器械的质量体系建设必须符合MDR下EN ISO 13485:2016。
针对遗留器械,MDR法规新增许多质量体系要求:包括上市后监督、市场监督、警戒系统、经济运营商和器械登记等,对此制造商最晚不迟于2024年5月26日已建立质量管理体系。