您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2024-04-26 21:28
一波未平一波又起,近日来,飞利浦正面临着与其设备召回相关的多项监管挑战!
4月25日,位于美国宾夕法尼亚州西区的地方法院法官 Joy Flowers Conti 批准了一项和解协议,将为购买或租赁飞利浦召回呼吸机设备的用户提供超过 5 亿美元(折合人民币36.2亿元)的赔偿。
根据判决,飞利浦必须为购买召回设备的用户以及退回公司的设备投入至少 4.675 亿美元的和解基金。该公司还必须拨出 3400 万美元作为付款人结算基金。 该协议还不包括人身伤害和医疗监测索赔,原告律师正在单独寻求这些索赔。
1、呼吸机美国地区已停售,但索赔未停止
该和解与飞利浦持续召回睡眠呼吸暂停设备和呼吸机有关,飞利浦于 2021 年 6 月开始召回这些设备,涉及产品数量1500万台,产品型号包含了双水平气道正压通气(Bilevel PAP、BiPAP 或 BPAP)和持续气道正压通气 (CPAP) 等系列产品,因为用于机器隔音的聚酯基聚氨酯 (PE-PUR) 泡沫可能会分解并被患者吸入,构成潜在的健康风险。

据报道,与 PE-PUR 泡沫破裂相关的问题可能会导致严重伤害,并且可能需要医疗干预以防止永久性伤害。
而在2024年1月底,飞利浦伟康(飞利浦睡眠和呼吸护理业务,Philips Respironics)宣布,由于正在努力遵守与美国FDA达成的和解,未来几年内将不会在美国销售新的睡眠呼吸暂停(Sleep Apnea)治疗设备。
2024 年 4 月 9 日,联邦地方法院发布了针对飞利浦伟康 (Philips) 的关于在美国地区停售呼吸机相关产品的同意令。同意令包括旨在优先考虑患者救济并确保公司遵守监管规定的关键条款。
在本次诉讼中,Levin Sedran & Berman律师兼原告联合首席律师桑德拉·杜根 (Sandra Duggan) 表示,此次赔偿大部分资金将流向用户,其中包括使用了设备的患者以及购买了召回设备的医院和睡眠中心。和解金额没有上限,这意味着赔偿金额可能会更高,具体取决于超出预先资助金额的索赔数量。
“对于此类赔偿来说,这是一笔巨额和解金,”杜根说。
每个用户将获得的金额取决于设备,将被召回的设备退回飞利浦还可获得 100 美元的固定付款。
“如果您购买了呼吸设备 Dreamstation,因为召回的设备中有三分之二是 Dreamstation,则支付的金额为 55.63 美元。如果您退回设备,您将再获得 100 美元,累计就是 155.63 美元。”杜根在接受采访时说道。“一些价格较高的设备(例如呼吸机)售价为 1,552.25 美元。”
如果人们在和解协议宣布之前购买了自己的替换设备,也可以获得付款。杜根表示,飞利浦将为这些索赔赔偿高达 1500 万美元。
和解协议的另一项条款是,为通过飞利浦召回计划获得再制造设备的任何人延长两年保修期。
根据 3 月 21 日的一份法庭文件,注册召回或参与和解并将设备退还给飞利浦的 150 万用户将获得自动付款,而无需申请这些赔偿。无论飞利浦是否上诉,赔偿金都将支付。
2、一波未平,影像设备也频受召回
无独有偶,飞利浦在4月23日,收到FDA警告信关于该机构发现飞利浦位于中国苏州的一家制造工厂,生产的计算机断层扫描 (CT) 和超声检查系统存在问题。
FDA 表示,这些设备因不符合良好生产规范要求而存在“掺假”。具体来说,FDA 发现飞利浦未能验证其 Incisive CT 机器中使用的定制数据电缆的注塑工艺,并且该公司未能向 FDA 报告过去的现场校正情况。
FDA于10月23日至26日检查了中国苏州的一家生产设施。检查人员发现,飞利浦未能向FDA报告与其Incisive CT机器相关的三项现场纠正问题。
问题之一是 CT 患者界面监视器的电缆连接故障,这可能会导致诊断延迟。另外两个涉及软件缺陷,可能导致图像反转或颠倒,或图像伪影,从而可能导致误诊。
飞利浦通过回顾性审查回应称,这三起未报告的现场纠正是唯一需要报告的召回事件。然而,FDA 还发现了其他旧召回报告,例如飞利浦 Insignia MR 设备在停电几天后失去系统访问权限的问题。
FDA 在警告信中还表示:“虽然贵公司的回顾性审查涵盖了过去两年,但考虑到之前发现的未报告的召回,建议进一步回顾(两年以上),以确保没有其他现场行动需要更正和删除报告。”
该机构补充说,飞利浦未能确保该公司定制 Incisive CT 患者接口监护仪数据电缆供应商所使用的注塑工艺得到验证。在接到 64 起电缆连接问题投诉后,该电缆被重新设计。
飞利浦首席患者安全和质量官 Steve C de Baca 在一份电子邮件声明中写道:“我们正在与 FDA 密切合作,解决警告信中提出的问题,并致力于及时完成必要的行动。”
飞利浦发言人史蒂夫·克林克(Steve Klink)在一封电子邮件中写道,警告信建议该公司延长现场安全通知的审查时间以及对供应给苏州的所有零部件的审查时间。他写道,检查结果不包括患者受到伤害的报告。
Klink 补充道,飞利浦苏州团队预计不会出现任何生产、运输中断或重大财务影响,苏州工厂主要供应美国以外的市场。
FDA在 1 月份发布了相关召回公告,称该软件缺陷影响了全球 828 台设备。此外,根据警告信,FDA 还发现了 19 份有关飞利浦其他放射设备召回的报告。
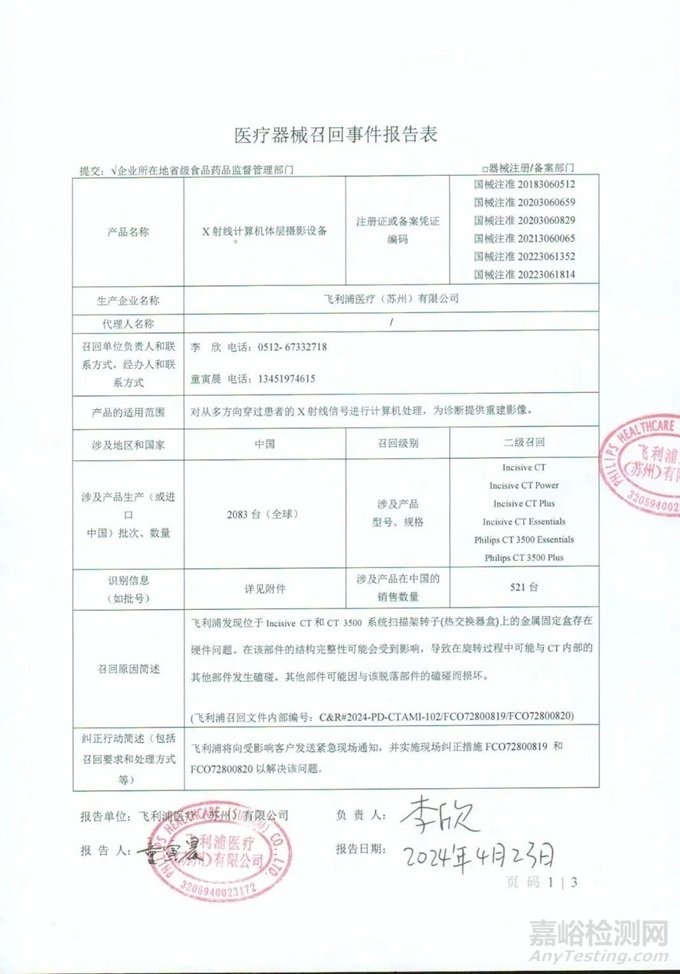
与此同时,飞利浦已对相关问题发起主动召回。4月24日,江苏省药监局官方消息,飞利浦医疗(苏州)有限公司报告,该企业发现位于Incisive CT 和CT 3500系统扫描架转子(热交换器盒)上的金属固定盒存在硬件问题,可能会在旋转过程中与CT内部的其他部件发生磕碰,其他部件可能因与该脱落部件的磕碰而损坏。现主动召回,召回级别为二级,召回范围针对全球,设备数量涉及2083台。涉及产品的具体信息见《医疗器械召回事件报告表》。
除此之外,在过去一年中,飞利浦因其影像设备存在可能导致严重伤害甚至死亡的安全问题而发起了几次重大召回:
有坠落风险--BrightView 影像系统召回:2024年2月,飞利浦召回了BrightView、BrightView X和BrightView XCT影像系统,因为检测器可能意外掉落,可能导致严重伤害,如颈部伤害、创伤性脑损伤甚至死亡。这次召回被FDA归类为I级召回,意味着存在严重伤害或死亡的高风险。这次召回在美国影响了553台设备,始于2023年12月。
有爆炸风险--Panorama 1.0T HFO MRI系统召回:2023年12月,由于在紧急冷却程序中,氦气压力过大可能导致爆炸,该型号被召回。这种情况可能导致化学暴露、缺氧、组织损伤和机械创伤,包括严重伤害或死亡。这次同样被归为I级召回的召回在美国影响了150台设备,始于2023年11月。
3、面对挑战,飞利浦仍对未来饱含信心
在2023年的财报中,飞利浦的年度销售额为181.7亿欧元,同比增长6%。其核心业务仍表现出让人欣喜的有机增长,其中诊断和治疗业务实现了11%的增长。此外飞利浦还表示将积极解决剩余呼吸机召回问题,并且有信心从第三季度开始恢复增长。
飞利浦在2023年还面临了运营和供应方面的挑战,这些挑战也影响了其业绩表现,但飞利浦在研发上的投入持续增加,以支持创新和产品质量的提升。
综上,尽管面临挑战但飞利浦通过专注核心业务增长和推动创新,以及积极应对召回问题和提升供应链韧性,仍然实现了销售额的增长,并对未来的可持续增长保持乐观态度。
也让我们持续关注飞利浦相关产品的未来走势,能否在2024年实现逆风翻盘。

来源:医疗器械创新网


