您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-04 11:32
雾化面罩是按第二类医疗器械管理的一次性使用雾化面罩产品,产品的分类编码为08-06-12(呼吸、麻醉和急救器械-呼吸、麻醉用管路、面罩-雾化面罩)和08-05-07(呼吸、麻醉和急救器械-呼吸、麻醉、急救设备辅助装置-雾化设备/雾化装置)项下面罩式气流雾化器产品。
一、雾化面罩的结构组成
雾化面罩通常由接口、罩体组成。
典型面罩式气流雾化器通常由接口、罩体(面罩),雾化杯、连接管组成,可配有固定带等。
罩体可采用聚氯乙烯、聚丙烯、聚碳酸酯、硅橡胶、热塑性弹性体(如TPE、TPU)等适宜的高分子材料制成;雾化杯可由聚乙烯、聚丙烯、聚碳酸酯等材质制成;连接管可由PVC等高分子材质制成;固定带可采用弹性材料制成。
典型面罩式气流雾化器产品通常由罩体(面罩)、雾化杯、连接管和接口组成,其结构示意图及实物照片(图1)如下所示。

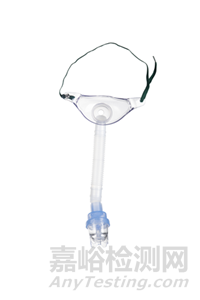
1-罩体2-接口3-雾化杯4-连接管
图1 典型面罩式气流雾化器结构示意图和实物照片
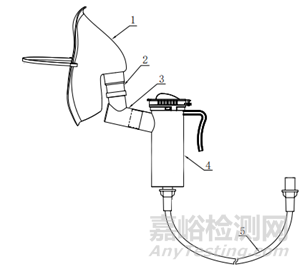
除典型产品外,其他类型产品如气切式、可躺手持式,产品图示如下所示。


1、固定带2、气切面罩3、接口4、波纹管5、雾化杯6、连接管
图2气切式雾化面罩结构示意图和实物照片

1、面罩壳2、面罩接头3、旋转接头4、雾化杯5、连接管
图3可躺手持式雾化面罩结构示意图和实物照片
二、雾化面罩的主要风险
雾化面罩的产品主要危险见表
表 产品主要危险
|
危险的分类 |
危险的形成因素 |
可能的后果 |
|---|---|---|
|
生物学危险 |
生产环境控制不好;灭菌操作不严格;包装破损;使用时操作不规范。 |
产品带菌,引起患者感染。 |
|
产品清洁度不好;未按照工艺要求配料;添加剂或助剂使用比例不正确。 |
小分子物质残留量过大,造成毒性危害。 |
|
|
原材料控制不严;生产工艺控制不严;后处理未达到要求。 |
引入有害物质,造成毒性危害;生物相容性不符合要求。 |
|
|
使用不当、标识不清。 |
引起感染、交叉感染。 |
|
|
环境危险 |
储运条件(如温度、湿度)不符合要求。 |
产品老化;无菌有效期缩短。 |
|
储运、使用过程中发生意外的机械性破坏。 |
产品使用性能无法得到保证。 |
|
|
使用后的产品没有按照要求集中销毁。 |
造成环境污染或交叉感染。 |
|
|
与医疗器械使用有关的危险 |
标记不清晰、错误;没有按照要求进行标记。 |
错误使用;储存错误;产品辨别错误。 |
|
包装破损无法识别;操作要点不突出;不适当的操作说明。 |
无法保证使用安全性;导致操作失误。 |
|
|
由不熟练/未经培训的人员使用。 |
操作不规范、不熟练、操作失误。 |
|
|
与医疗器械使用有关的危险 |
规格型号选择不合理。 |
面罩与接头不匹配,无法连接使用;与患者面部不吻合,达不到雾化效果。 |
|
产品设计不合理,如面罩罩体缺少孔。 |
窒息危险。 |
|
|
对一次性使用医疗器械很可能再次使用的危害警告不适当。 |
一次性使用产品的重复使用造成交叉感染。 |
|
|
功能性失效和老化引起的危险 |
产品标识不清或没有标识。 |
超出有效期的产品被使用,造成细菌感染或因材料老化而导致产品性能不符合要求。 |
|
没有进行包装确认。 |
不能保证产品无菌,造成产品污染,从而导致出现细菌感染。 |
三、雾化面罩性能研究实验要求
1、产品性能研究
应当开展产品性能研究以及产品技术要求的研究,明确包括有效性、安全性指标以及与质量控制相关的其他指标的确定依据、所采用的标准或方法、采用的原因及理论基础等。明确雾化粒径的确定依据。对于仅含有面罩和接头的产品,应明确配套使用的雾化杯、连接管的要求,并开展相应性能研究。
明确产品生产过程中由起始材料至终产品所需全部材料(包括添加剂、助剂等)的基本信息,如部件、化学名称、商品名/材料代号、供应商、生产商、符合的标准等。原材料应具有稳定的供货渠道以保证产品质量,应明确所用原材料的质量控制标准和检验报告。
开展典型药物雾粒空气动力学研究。对于可雾化的药物,建议参考相关标准如YY/T 1743《麻醉和呼吸设备雾化系统和组件》开展药物雾粒空气动力学特性(空气动力学直径(MMAD)、气雾颗粒输出、喷雾速率等)的研究。
对于首次应用于医疗器械的新材料,应开展该材料适用性相关研究。有特殊设计、性能和结构的,应开展相应研究和验证。
2、生物相容性的评价研究
生物相容性评价研究应当明确生物相容性评价的依据和方法;产品所用材料及与人体接触的性质;实施或豁免生物学试验的理由和论证;对于现有数据或试验结果的评价。
应根据产品所用材料及与人体的接触性质、接触时间,参照GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》进行生物学评价,开发人应参考YY/T1778.1《医疗应用中呼吸气体通路生物相容性评价第1部分:风险管理过程中的评价与试验》评价气体通路生物相容性。
若开展申报产品与市售产品的等同性比较的方式进行生物相容性评价,应按照《关于印发医疗器械生物学评价和审查指南的通知》要求进行评价,应能够证明申报产品与已上市产品具有等同性。
3、灭菌工艺研究
申报产品为无菌提供,应明确灭菌工艺(方法和参数)和无菌保证水平(SAL),开展灭菌确认,并对残留毒性开展研究。主要原材料不同、灭菌方式不同的产品,应分别开展相关研究。
应参考GB 18279系列标准、GB 18280系列标准和GB/T 16886.7《医疗器械生物学评价第7部分:环氧乙烷灭菌残留量》明确产品包装及灭菌方法选择的依据,经过确认并进行常规控制。
4、稳定性研究
4.1货架有效期
应开展产品货架的验证,证明在货架有效期内,产品可保持性能功能满足使用要求。不同灭菌方式、不同包装材料的产品,应分别进行有效期验证和包装研究。
产品有效期的验证可采用实时老化或加速老化的研究。在稳定性研究中应监测整个有效期内确保产品安全性和有效性的关键参数。加速老化研究试验的具体要求可参照YY/T 0681系列标准。
在进行加速老化试验研究时应注意:产品选择的环境条件的老化机制应与宣称的运输储存条件真实下发生产品老化的机制相匹配。实时老化的研究是唯一能够反映产品在规定储存条件下实际稳定性要求的方法,当加速稳定性试验与实时稳定性试验结果不一致时,应以实时稳定性试验结果为准。
4.2运输稳定性
应当开展运输稳定性和包装研究,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。可参考GB/T 4857系列标准开展研究。
包装验证:应包括封口试验以及包装材料对灭菌的适应性研究。可参考GB/T 19633系列标准、YY/T 0698系列标准、YY/T0681系列标准开展研究。
5、证明产品安全性、有效性的其他研究
开展申报产品与预期接触的药物相容性研究。如申报产品原材料工艺等与已上市产品相同的,可通过已有的文献、数据和信息资料进行说明;采用新材料、新工艺的产品,应开展相应的试验数据和分析评价。
6、其他
非无菌供应的雾化面罩管理类别为一类,无菌供应的雾化面罩管理类别为二类,08-06-12项下雾化面罩依据《免于临床评价医疗器械目录》(以下简称《目录》)第一项“一类医疗器械目录中灭菌后升二类的医疗器械产品”免于临床评价。开发人可按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》要求将申报产品相关信息与《目录》所述内容进行对比及申报产品与已获准境内注册的《目录》中医疗器械进行对比。
08-05-07项下面罩式气流雾化器已列入《目录》,开发人可按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》要求将申报产品相关信息与《目录》所述内容进行对比及申报产品与已获准境内注册的《目录》中医疗器械进行对比。

来源:嘉峪检测网


