您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-14 10:00
导语:医疗器械的同品种对比是临床评价的重要手段之一,之前撰写过2024年医疗器械同品种临床评价指导原则「全网最全」、浅谈医疗器械同品种等同性论证技术要点、以血管内导管产品为例探讨同品种对比临床评价攻略和浅谈电子内窥镜同品种临床评价要求。本文基于前文撰写的基础,整理关于如何进行医疗器械的同品种对比,以为诸君提供点滴参考。
第一部分:同品种的条件
申报产品与对比器械具有相同的适用范围,且对比器械为境内已上市产品。
医疗器械的适用范围及临床使用信息是确保其安全性和有效性的重要组成部分。适用范围定义了医疗器械预期使用的临床情境,包括预防、诊断、缓解、治疗或监护的疾病或症状,以及适用的患者人群、部位、接触方式和时间等。临床使用信息则涵盖了使用方法、禁忌证、警告和预防措施等。
需要比较申报产品与已上市对比器械的适用范围和临床使用信息,从多个维度进行识别和阐述差异,并科学评价二者是否相同。例如,若两者在适应证、使用人群、部位、使用条件等方面存在显著差异,可能会导致临床安全有效性的显著差异,从而判定适用范围不同。
然而,即使存在适应证等差异,如果差异不会引起临床安全有效性的显著差异,例如两种器械虽适应证不同,但对于产品的使用,不同的适应证之间具有同质性,则可认为二者具有相同的适用范围。
例如,常规设计的非骨水泥固定髋关节假体,适用范围可描述为“作为非骨水泥型髋关节假体,适用于具有髋关节置换术适应证的骨骼成熟患者的髋关节置换,以恢复关节功能,缓解疼痛”。该类产品的适应证可包括原发性退变性髋关节骨关节炎、股骨头缺血性坏死进入第IV期、类风湿性关节炎或强直性脊柱炎等全身疾病累及髋关节、髋部创伤后骨关节炎,均为髋关节置换术的适应证,从髋关节置换适用性的角度,具有同质性。当申报产品与对比器械均在上述适应证的范围内,但二者存在差异时,注册申请人可经充分论证,证明申报产品与对比器械在适应证存在差异的情形下,具有相同的适用范围。”
医疗器械临床评价等同性论证技术指导原则
第二部分:同品种对比的步骤
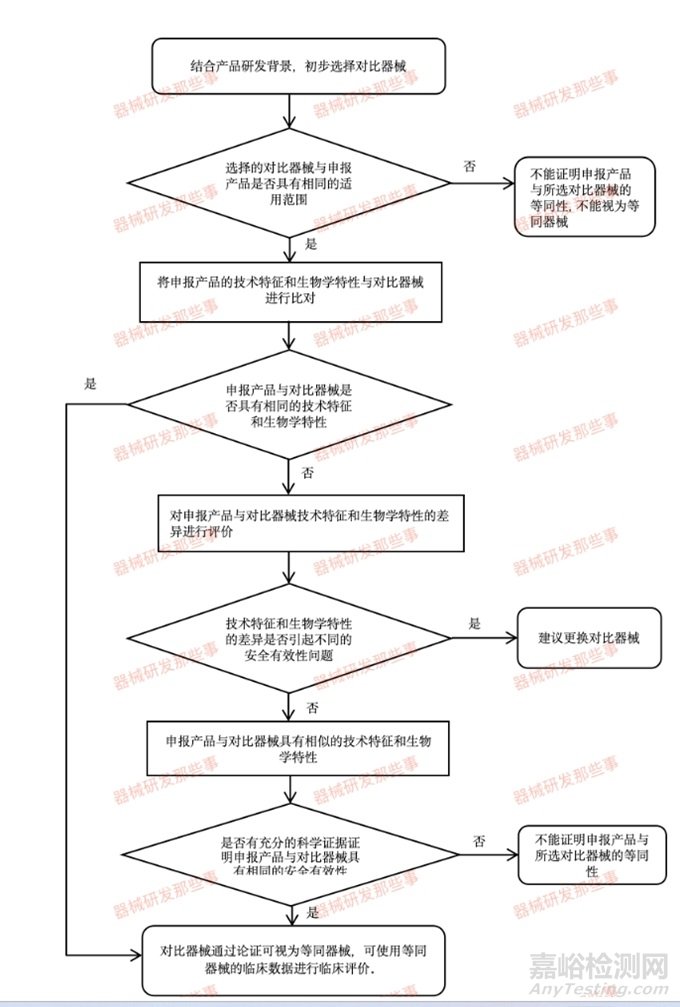
等同性论证是证明对比器械与申报产品具有基本等同性的过程,所谓基本等同性包括以下两种情形:
(1)申报产品与对比器械具有相同的适用范围、技术特征和生物学特性;
(2)申报产品与对比器械具有相同的适用范围,相似的技术特征和生物学特性;有充分的科学证据证明申报产品与对比器械具有相同的安全有效性。
进行医疗器械的同品种对比,需要遵循一系列详细的步骤和原则。以下是具体的操作方法:
1.选择合适的对照品:
对照品的器械预期用途应与申报器械一致。
适应证存在巨大差异时,应考虑不作为对比器械。
医疗器械临床评价的导则强调了几个重要的变化和原则。首先,对比器械的选择需满足相同适用范围的要求。
其次,对比器械的选择不仅需在适用范围上相同,还应关注技术特征和生物学特性。这些要素的考虑有助于确保评价的全面性和准确性。选择对比器械时,应考虑其与申报产品在技术特征和生物学特性上的相似性。
此外,导则还明确了对比器械应在境内获准注册的要求,这是基于业界意见和考虑后的重要调整。这一要求有助于确保对比器械的可靠性和安全性,并简化等同论证过程。
鼓励申请人在可行的前提下选择本企业改进前的产品,如前代产品或同系列产品作为对比医疗器械。
在实际操作中,选择对比器械的数量应适度,避免过多导致评价过程的复杂化。建议根据实际情况选择最相似的主要对比器械,尽量减少其他对比器械的数量,以提高论证的通过性和成功率。当出现以下情况,可能采用多个对比器械。
1.若申报产品结合了来自多个对比器械的设计特征,在申报产品与多个对比器械具有相同适用范围的前提下,若不同的设计特征在申报产品中组合时不会相互影响,或不同设计特征的组合分别与多个对比医疗器械相比,没有引起不同的安全性有效性问题;2.若申报产品结合了多个对比医疗器械的适用范围,在申报产品与多个对比器械具有相同适用范围的前提下,若不同的适用范围在申报产品中组合时不会相互影响,或不同适用范围的组合分别与多个对比医疗器械相比,没有引起不同的安全性有效性问题。
医疗器械临床评价等同性论证技术指导原则
2.详细对比分析:
按照《医疗器械临床评价技术指导原则》的要求,对申报产品与同品种产品在基本原理、结构组成、生产工艺、性能要求、安全性评价等方面进行逐项对比,确保两者在关键指标上基本等同。
如果选取其他注册人的产品作为医疗器械同品种进行对比,需获取同品种医疗器械的生产工艺、临床数据等资料。
3.临床床数据收集及分析
通过同品种医疗器械的临床数据对申报产品进行临床评价,详述二者的相同性和差异性。
如果申报产品与同品种产品存在差异,可以引入第二个同品种产品即“同品种2”作为差异性的证据。
4.等同性论证:
在进行等同性论证时,主要对比的内容包括产品技术要求中的性能指标。
需要确保申报产品与同品种产品在关键性能指标上基本一致,并提供相应的安全有效性证据。
5.早期介入:
建议从研发立项就介入同品种对比相关工作,因为产品研发关联适用范围、产品技术要求、生物学特性等内容。
6.综合评价:
综合考虑材料、结构、用途等多方面因素,以选择最适合特定情况的产品。
通过案例分析和综合评价,可以为医疗器械的选择提供有力的参考,从而提升医疗质量,为患者提供更安全、有效的治疗方案。
7.非技术性问题:
在实际操作中,可能会遇到一些非技术性问题,如何时开始同品种对比相关工作、如何选择合适的对照品等。这些问题需要提前规划并解决。
通过以上步骤和原则,可以系统地进行医疗器械的同品种对比,确保申报产品在预期用途下对患者的安全性和有效性得到充分证明。
第三部分:如何有效收集和分析临床数据以证明其有效性和安全性?
在进行医疗器械同品种对比时,有效收集和分析临床数据以证明其有效性和安全性需要遵循以下步骤:
选择合适的对比产品:首先,需要找到与申请产品差别不大且已经在国内上市的产品作为对比产品。理想的对比产品应具备相似的适用范围和临床使用情况。
数据收集方法:根据研究目标及数据源选择合适的采集工具,包括纸质版和电子两种方式。常见的数据收集方法有问卷调查、临床观察、实验室检测等。此外,还可以利用医疗数据库进行数据的存储、管理和检索。
数据管理:在数据收集过程中,需要进行详细的记录和管理,确保数据的准确性和一致性,避免数据的缺失和错误。数据管理的重要性在于能够帮助评估治疗方案的成功率和风险性,并为研究提供可靠的支持。
数据分析:通过对同类已上市医疗器械的临床试验或临床使用获得的数据进行分析,证明两者在基本性能上的等同性。具体来说,需要对申报产品与对比器械的适用范围及临床使用相关信息进行比较,充分识别二者之间的差异,并进行详细阐述和科学评价。
安全性评价:在数据分析中,要尽可能全面地收集安全性和耐受性变量,包括不良事件的种类、严重程度、开始时间和持续时间,以及处理方法和结果。这有助于全面评估产品的安全性。
第四部分:哪些非技术性问题最常见,以及如何解决这些问题?
在医疗器械同品种对比中,非技术性问题较为常见且复杂。以下是一些常见的非技术性问题及其解决方法:
对比器械需已在境内上市:为了确保对比的合法性和有效性,必须确保所选择的对比器械已经在国内市场上市。
对比器械数量:尽量减少对比器械的数量,但若因功能组合等原因需要增加,则应合理解释理由。
无技术资料:如果缺乏技术资料,可以通过检验、试验等方式获得相应的数据进行对比。
适应证扩展:若想将对比产品用于新的适应证可以应用该产品的超适应症使用的文献数据,但需要注意的是,国内的超适应症与国外的批准情况可能不同。
早期介入:建议从研发立项阶段就介入同品种对比相关工作,以确保产品研发过程中考虑与对比器械的差异性。
详细说明相同性和差异性:在临床评价报告中,详细如实说明与对比产品的相同性和差异性,并对差异性进行逐条分析,合理采用非临床证据、临床文献资料、临床经验数据等信息验证产品的安全性和有效性。
质量管理和人员培训:提高人员素质和管理水平,避免操作不规范和技术不到位的问题,从而提升质量控制的效果。
第五部分:如何确保产品技术要求中的关键性能指标与同品种产品基本一致?
在医疗器械同品种对比中,确保产品技术要求中的关键性能指标与同品种产品基本一致,可以采取以下步骤:
参考相关标准:首先,应参考相关的国家标准或行业标准来制定技术要求中的性能指标。这些标准通常会提供一系列通用的、经过验证的性能参数和测试方法,有助于确保不同产品的性能指标具有可比性。
合理设定性能指标:在设定性能指标时,需要确保其合理性和科学性。这包括对产品功能性、安全性等关键性能指标进行客观判定,并结合具体产品的实际情况进行调整和优化。
对比分析竞品:在编写技术要求时,需提供申报产品与已获准境内注册的《目录》中医疗器械的对比说明表格。该表格应涵盖工作原理、组成、性能指标和消毒工艺等方面的内容,以确保新产品的性能指标与同品种产品基本一致。
技术审查重点:在注册技术审查过程中,医疗器械技术审评机构会特别关注产品技术要求是否符合适用的强制性标准要求,以及性能指标的合理性。因此,在编写技术要求时,必须确保所有性能指标都符合相关标准,并且能够通过合理的检验方法进行验证。
标准化和可证实性原则:在编写技术要求时,应遵循“性能特性原则”和“可证实性原则”,即只要可能,产品的要求应由性能特性来确定,并且这些要求应当是可证实的。这样可以确保技术要求中的性能指标既科学又实用,便于与其他同品种产品进行对比。
结束语:本文围绕同品种对比开展的前提条件、同品种对比开展的步骤以及如何确保产品技术要求中的关键性能指标与同品种产品基本一致性等内容进行了详细介绍,以为诸君提供点滴参考。

来源:器械研发那些事


