您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-29 18:24
近期,武汉理工大学戴红莲教授和涂溶教授在科爱创办的期刊Bioactive Materials上发表文章:基于没食子酸-镁金属有机框架的可喷涂水凝胶,持续调节糖尿病伤口氧化应激微环境并促进神经血管网络重建。目前,糖尿病伤口治疗的面临高氧化应激水平和持续炎症导致愈合缓慢及后期神经血管网络难以重建。针对这一难题,作者提出了一种通过没食子酸-镁金属有机框架(Mg-GA MOF)持续调节氧化应激微环境的策略,并基于海藻酸钠(SA)/壳聚糖季铵盐(HACC)开发了可喷涂水凝胶敷料来治疗糖尿病伤口。壳聚糖季铵盐具有抗菌性能,可预防创面细菌感染。具有类酶催化功能的Mg-GA MOF在早期快速清除活性氧并加速M1型巨噬细胞向M2型的极化。修复后期维持氧化还原平衡并通过镁离子辅助治疗促进血管再生和神经元形成。可喷涂水凝胶敷料通过调节氧化应激水平,促进神经血管网络重建,加速上皮再生和胶原蛋白沉积,快速修复糖尿病伤口。
慢性糖尿病伤口是糖尿病患者最常见的并发症。高氧化应激水平会延长炎症期并对细胞造成氧损伤阻碍血管神经再生,其影响糖尿病伤口的整个愈合过程,仍是治疗糖尿病伤口一大挑战。清除过量活性氧是加速慢性糖尿病创面修复的有效策略之一。天然多酚(例如:单宁酸、没食子酸、茶多酚等)是生物相容性良好的抗氧化剂和抗炎剂,但酚羟基的不稳定性及无法长期持续催化极大程度上限制了多酚基材料的应用。因此,如何提高多酚材料在治疗慢性糖尿病伤口中的催化效率以持续降低氧化应激水平,并增强修复后期血管和神经的网络重建是促进糖尿病伤口快速愈合的关键。基于此,本研究利用微波辅助合成技术优化bio-MOF的合成方法,获得单分散且形貌均匀的没食子酸-镁金属有机框架(Mg-GA MOF),提高其水中稳定性,实现了Mg-GA MOF合成-结构-性能之间的有效调控,并将其负载在具有可预防细菌感染的可喷涂水凝胶中构建了新型抗菌凝胶喷雾用于糖尿病伤口修复。在伤口修复的早期阶段,Mg-GA MOF释放的GA迅速清除ROS,降低氧化应激水平,实现高效抗炎。在伤口修复后期,Mg-GA MOF在生物降解过程中不断释放GA和Mg2+,以维持氧化还原平衡的同时通过镁离子辅助治疗激活血管相关基因的表达来促进血管再生和神经元形成。此外,在可喷涂水凝胶中加入壳聚糖季铵盐(HACC)是一种有效的抗菌成分,以实现对细菌的抑制和消除。具有抗菌、抗氧化和炎症调节功能的可喷水凝胶敷料通过调节氧化应激水平,促进神经血管网络重建,加速再上皮化和胶原蛋白沉积来快速修复糖尿病伤口(图1)。
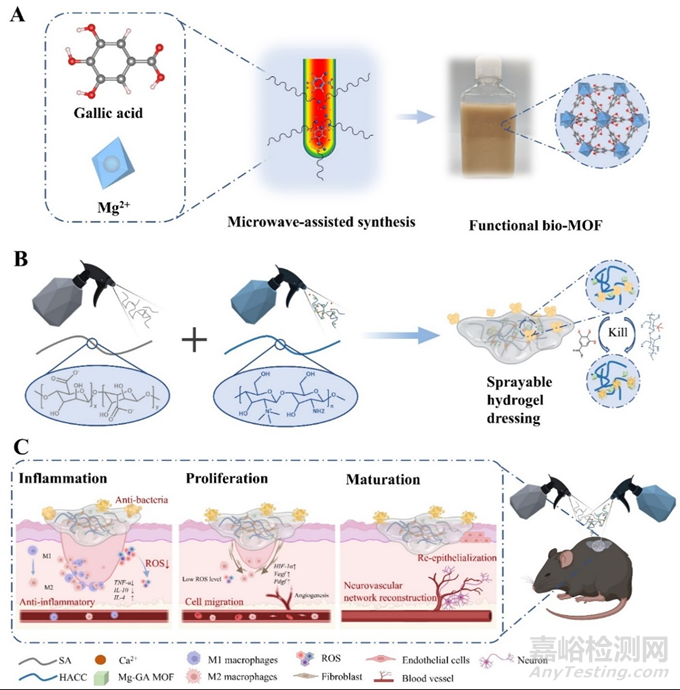
图1.(a)Mg-GA MOF的合成,(B)含Mg-GA MOF的可喷涂水凝胶敷料的合成,以及(C)促进慢性糖尿病伤口修复的机制示意图
一、Mg-GA MOF的形貌调控及连续释放没食子酸
生物MOF材料已被广泛研究和应用,但其在水中的不稳定性是制约其发展的关键因素。通常,稳定的MOF结构具有更广泛的应用潜力。现有合成方法的基础上,采用微波辅助合成技术制备没食子酸-镁金属有机骨架(Mg-GA MOF),并在合成过程中加入二甲基甲酰胺(DMF)以优化合成方法。与在高温(>120℃)下需要较长时间(12~24h)的传统水热合成法相比,该方法在相对较短的时间内(30min)快速获得单分散、粒径均匀的Mg-GA MOF。DMF的存在增强了溶剂的极性,加快了反应速度。同时,DMF的水解产物甲酸和二甲胺分别作为调节剂和去质子化溶质调控Mg-GA MOF的晶体形貌。Mg-GA MOFs在20 % DMF/水体系下为双锥体,随着DMF浓度增加到60 %,逐渐变为立方体,最后在80 %DMF/水溶剂体系下变为球体(图2)。对Mg-GA MOF晶体形貌的调控提高了其在水中的稳定性,有助于提高其催化性能。
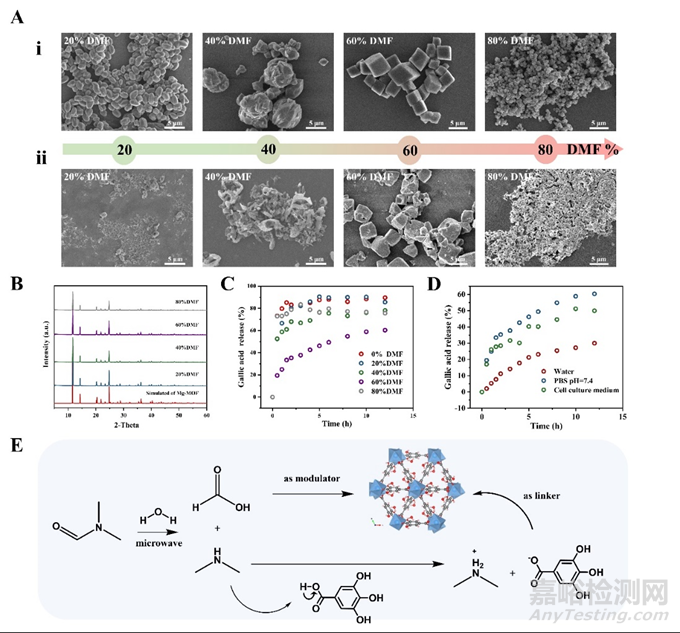
图2. DMF调控Mg-GA MOF晶体形貌及影响没食子酸持续释放
二、Mg-GA MOF类酶催化体外清除ROS
对于慢性糖尿病伤口,过量的ROS是影响伤口愈合速度的最关键介质。为了确定Mg-GA MOF是否具有模拟酶催化的能力,本研究进行了一系列ROS清除实验,包括超氧阴离子(O2•-)、过氧化氢(H2O2)、羟基自由基(•OH)和1,1-二苯基-2-三硝基肼基自由基(DPPH•)等典型代表。由于Mg-GA MOF对ROS的催化还原主要与配体GA和MOF的表面活性位点有关,因此将Mg-GA MOF与GA和常见的抗氧化剂抗坏血酸(维生素C)进行比较,以评估Mg-GA MOFs清除各种自由基的能力。结果表明,具有酶催化能力的Mg-GA MOF可以清除各种活性氧自由基并维持氧化还原平衡。值得注意的是,Mg-GA MOF的类SOD和类CAT活性在级联催化反应中具有潜在的清除O2•-和H2O2的优势。MG-GA MOF的类CAT活性的剂量依赖性小于类SOD活性和•OH清除的剂量依赖,有效地避免了类SOD活性催化引起的H2O2积累和芬顿反应导致额外的•OH生成(图3)。此外,低剂量Mg-GA MOF有效清除RNS性能打破了过氧亚硝酸根阴离子(ONOO-)的积累,避免了亚硝化应激,这种RNS很容易引起DNA断裂和脂质过氧化。
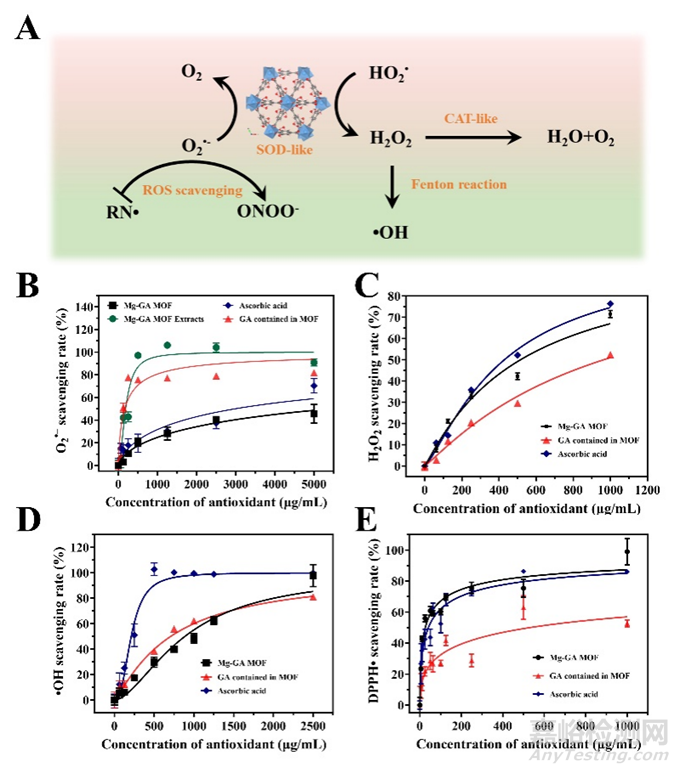
图3. Mg-GA MOF具有清除ROS的酶催化功能图
三、Mg-GA MOF的体外抗炎和抗氧化能力
对于慢性糖尿病伤口,持续的氧化应激和受损的免疫环境是阻碍伤口愈合的关键。在LPS构建的RAW264.7巨噬细胞炎症模型下,Mg-GA MOF可降低炎症状态下RAW264.7细胞的胞内活性氧水平,并促进RAW264. 7细胞M1向M2的极化。结果表明Mg-GA MOF具有体外抗炎活性。Mg-GA MOF持续释放GA与ROS的快速反应有效保护了暴露在H2O2氧化环境中的hUVEC,L929和HaCaT细胞,并有效降低胞内氧化应激水平(图4)。Mg-GA MOF的长期降解实现了氧化应激平衡的长期维持,这对后期损伤修复的效率和后期损伤修复的功能重建至关重要。
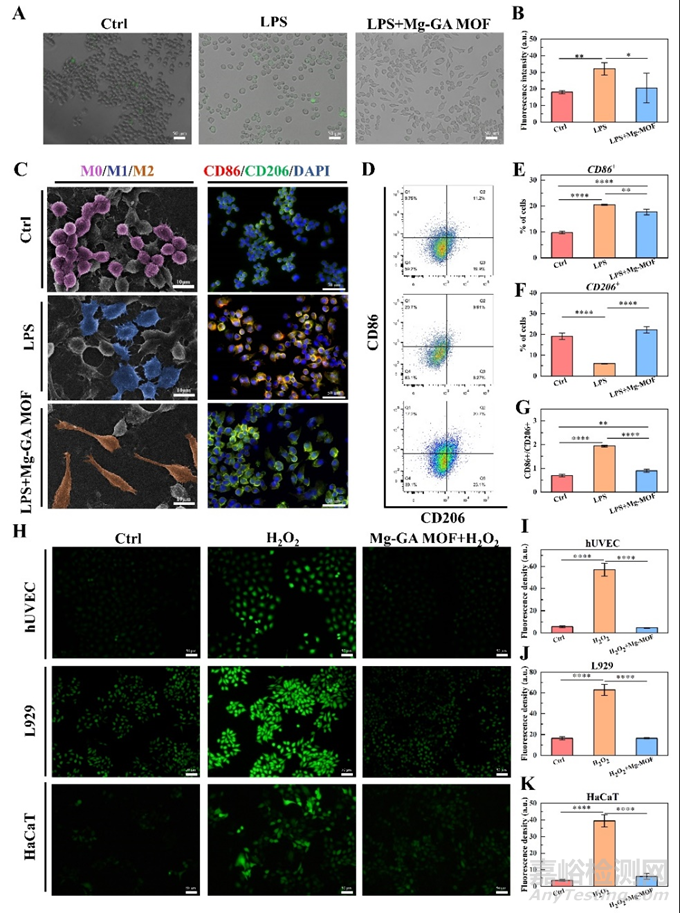
图4. Mg-GA MOF的体外抗炎和抗氧化能力
四、Mg-GA MOF促进体外内皮细胞迁移和小管形成
血管生成在组织再生中起关键作用,取决于血管内皮细胞的迁移和血管网络的重建。划痕测定实验结果显示50 μg/mL Mg-GA MOF处理组的hUVEC细胞迁移范围显著大于未处理组。处理24h后,Mg-GA MOF组的迁移率达到71.45%。同时体外成小管实验结果显示,与未处理的对照组相比,Mg-GA MOF培养的hUVEC在两个处理时间都可以显著促进小管形成。对分枝数和管长的半定量统计数据均进一步证实了这一结果(图5)。综上所述,Mg-GA MOF持续释放的Mg2+显著促进血管内皮细胞迁移和增强体外小管形成,这在血管重建中具有潜在的关键作用。
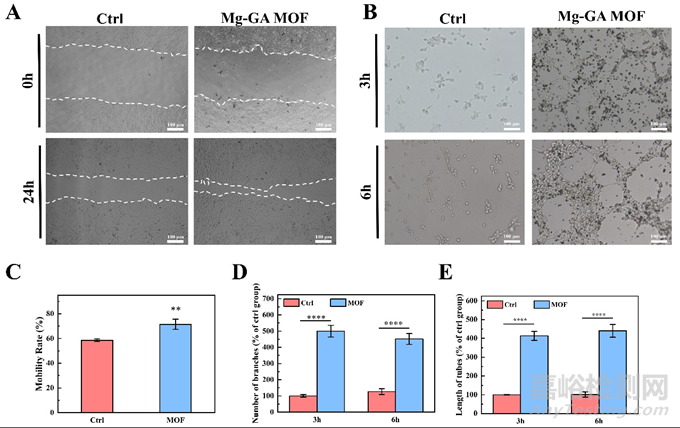
图5. Mg-GA MOF的体外成血管能力
五、Mg-GA MOF基可喷涂凝胶敷料制备及抗菌能力
为了在糖尿病伤口中有效地递送Mg-GA MOF,本研究合成了基于Mg-GA MOF的可喷涂水凝胶敷料(Gel/MOF)。水凝胶敷料的溶胶-凝胶转化是通过海藻酸钠(SA)的水溶液和含有Mg-GA MOF的壳聚糖季铵盐(HACC)的钙离子溶液互喷实现的。雾化的SA和钙离子溶液在约数十秒内快速交联(图6A-C)。通过菌落形成单位测定(CFU)和抑菌圈实验评估Mg-GA MOF和Gel/MOF的抗菌效果。GA及其衍生物的抗菌性能需较高的剂量依赖(IC50~500μg/mL)且需要在溶液中释放,导致Mg-GA MOF对S.aureus和E.coli抗菌效果不显著。将阳离子抗菌剂季铵盐改性壳聚糖引入到Gel/MOF中,提高了水凝胶敷料的抗菌敏感性。季铵盐吸附细菌后,水凝胶敷料中的Mg-GA MOF持续释放GA。值得注意的是,Gel/MOF的抗菌效果主要源于阳离子抗菌剂季铵盐,在不添加壳聚糖季铵盐的对照组中,即使添加GA或MOF也没有观察到明显的抗菌效果(图6)。因此,Gel/MOF在抑制伤口中的细菌增殖和预防细菌感染方面具有潜在优势。
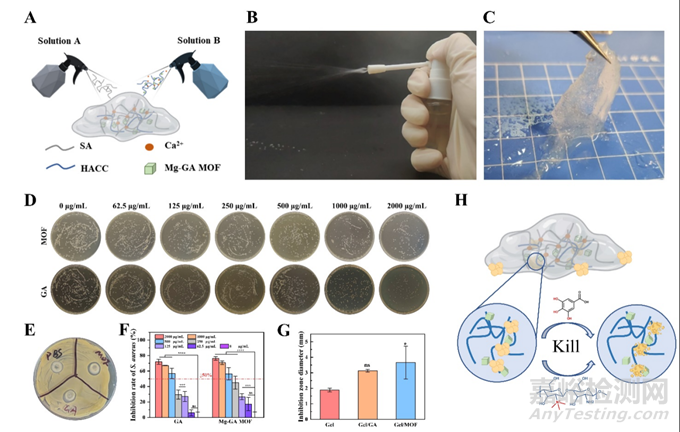
图6. Mg-GA MOF和可喷涂水凝胶敷料Gel/MOF的体外抗菌能力
六、可喷涂水凝胶敷料Gel/MOF促进体内糖尿病伤口愈合
为了验证可喷涂水凝胶敷料是否加速糖尿病伤口修复,本研究在db/db糖尿病小鼠中直径为6 mm的全层皮肤缺损模型上对Gel/MOF进行评价(图7)。在手术后的前3天,组之间没有显著的差距。Gel/MOF组的愈合速度从手术后8天开始显著加快,表明Mg-GA MOF对巨噬细胞的正调节和持续释放的GA降低ROS水平导致糖尿病创口从炎症阶段转变为增殖阶段。与对照组和Gel组相比,Gel/MOF组伤口愈合率显著提高,显著加快伤口愈合速度。Gel/MOF治疗16天后的再生皮肤组织组织切片H&E染色结果证实了这一结果,且再生组织与周围皮肤组织几乎相同,可见更多的血管、毛囊、皮脂腺和表皮再上皮化。除此之外,Masson染色结果及半定量分析结果显示Gel/MOF组中呈现出更多的胶原沉积,同时天狼星红染色结果显示与对照组胶原蛋白呈黄绿色,Gel和Gel/MOF处理后胶原蛋白变为橙黄色和鲜红色,Gel/MOF组具有比对照组和凝胶组更高的胶原蛋白I/III比率。这些结果表明,Gel/MOF促进表皮再上皮化及胶原沉积,并调节I型和III型胶原表达以促进伤口愈合。

图7. 可喷涂水凝胶敷料Gel/MOF加速体内糖尿病伤口愈合,促进胶原沉积和再上皮化
七、Gel/MOF抑制糖尿病创面氧化应激和调节炎症反应
本研究通过一系列实验验证了Gel/MOF可以通过降低氧化应激和调节炎症反应来加速体内炎症—增殖转变。对再生组织进行胞内总活性氧免疫荧光染色,结果显示与对照组相比,术后第8天Gel和Gel/MOF处理后的ROS+细胞密度极其显著地降低,且Gel/MOF的ROS+细胞密度显著低于凝胶组,表明MOF的存在促进了ROS的清除并极大地缓解了糖尿病伤口中氧化应激的微环境。进一步地使用RT-qPCR检测再生皮肤组织中的炎症相关基因,结果显示,尽管Gel/MOF组中的TNF-α基因表达没有显著降低,Gel/MOF组中的抗炎因子IL-10和IL-4的表达显著高于对照组和Gel组。此外,从Gel和Gel/M0F组提取蛋白,然后使用细胞因子蛋白阵列检测炎症相关蛋白。在Gel/MOF组中,促炎因子及相关趋化因子地表达降低,而抗炎因子IL-1ra增加(图8)。结果均表明,在Gel敷料中加入MOF可增强M1型巨噬细胞向M2型极化,并积极调节炎症微环境,降低氧化应激以促进伤口愈合。
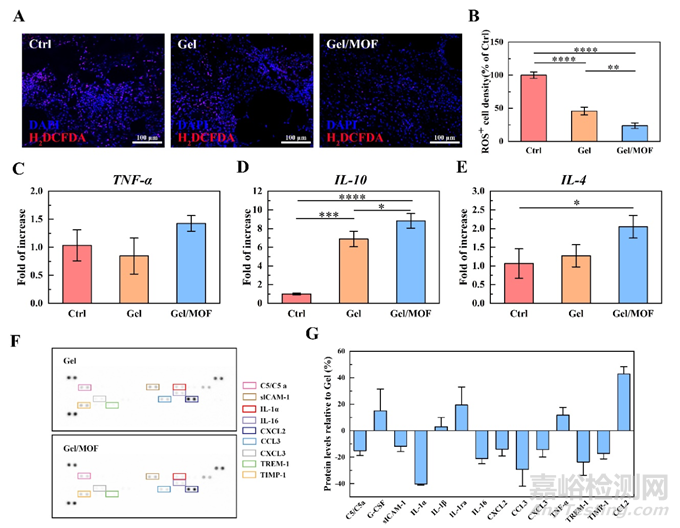
图8. 可喷涂水凝胶敷料Gel/MOF调节糖尿病伤口中的炎性细胞因子表达并抑制氧化应激
八、Gel/MOF加速神经血管网重建
氧化应激微环境直接影响血管和神经再生。为了研究MOF维持氧化还原稳态是否可以在增殖阶段期间促进血管神经再生,研究人员检测了再生组织的血管相关基因并对血管和神经元进行CD31、β3-微管蛋白和NF200免疫荧光标记。Gel/MOF处理后HIF-1α表达与TNF-α相似。Mg-GA MOF释放Mg2+上调Vegf和Pdgf的表达。同时,免疫荧光结果显示Gel/MOF组可见大量CD31表达且在其周围呈现大量连续条状的β3-tubulin+着色,而对照组及Gel均较少(图9)。这些结果表明Gel/MOF促进血管内皮细胞的增殖、迁移和新血管的形成,同时伴随着新生的神经网络,其治疗后的皮肤具有更好的修复效果。

图9. 可喷涂水凝胶敷料Gel/MOF加速神经血管网络重建
综上所述,本研究成功制备了分散性好且形貌可调的Mg-GA MOF,实现了Mg-GA MOF合成-结构-性能之间的有效调控,并将其负载至具有抗菌性能的可喷涂水凝胶敷料中,作为微环境调节剂用于治疗慢性糖尿病伤口。Mg-GA MOF具有类酶催化活性,可通过降解释放GA快速清除ROS,维持氧化还原平衡,有效调节慢性糖尿病创面微环境。在伤口修复的后期,Mg2+辅助治疗可促进神经血管网络重建,而抗菌水凝胶敷料可预防细菌感染。这种简单方便的可喷涂水凝胶敷料为慢性糖尿病伤口提供了一种非药物治疗的新策略。
原文信息
Chenxi Lian, Jiawei Liu, Wenying Wei, Xiaopei Wu, Takashi Goto, Haiwen Li, Rong Tu**, Honglian Dai,
Mg-gallate metal-organic framework-based sprayable hydrogel for continuously regulating oxidative stress microenvironment and promoting neurovascular network reconstruction in diabetic wounds.
Bioactive Materials, 38 (2024) 181–194. DOI: 10.1016/j.bioactmat.2024.04.028

来源:Internet


