您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-29 18:38
本文将从规格型号、性能对比、性能制定、临床评价四个方面介绍无源产品NMPA注册发补常见的问题,对于国内初创企业和刚从事国内医疗器械注册的小伙伴有较高的参考价值。
第一部分:规格型号的定义
国内的耗材企业有个显著特点,喜欢在注册证上囊括多个型号产品。对于新成立的企业,规格型号定义不合理成了发补中的高频问题。规格型号在发补中的问题常见于以下几种情形。
1. 不同结构设计的产品型号相同
2. 多余的规格信息描述
3. 缺少规格型号列表
4. 规格间特征有差异缺少图示
(一)不同结构设计的产品型号相同
以下面胸腰椎钉棒为例,表中4种钉棒结构设计,组成完全不一样,却设置了相同的型号,改成表2才合理。
表1 修改前
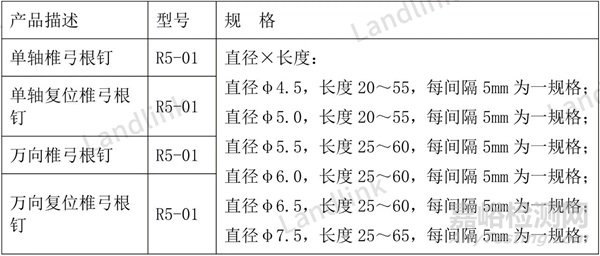
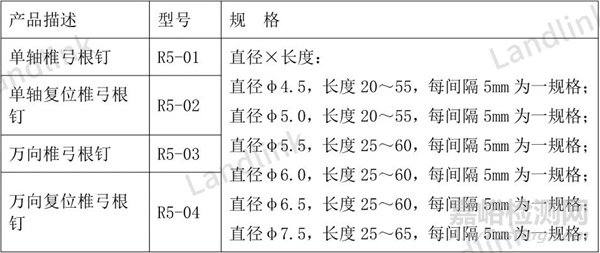
表2 修改后
(二)多余的规格信息描述
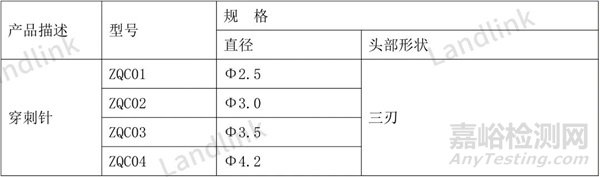
表3是最初提交的规格型号表,由于型检只测了三刃的,审评老师觉得型检样品不能覆盖所有头部形状,要求补充检验,后面企业选择删减部分规格型号,更新后的规格型号表4所示。
这时由于只有一种头部形状了,就没有必要把形状作为规格信息体现出来了,甚至,如果不考虑后面变更时增加型号,连前面的4种型号都不需要了,只需要直径规格信息即可。
表3 修改前
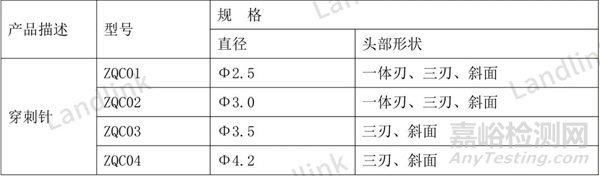
表4 修改后
(三)缺少列表
修改前:规格型号众多,缺少列表不直观
以下面正畸颊面管为例,型号的定义很复杂,不附上一张最终的规格型号列表审评老师是很难直观感受正确的规格型号表达格式的。
正畸颊面管按临床矫治技术要求可分为方丝弓、直丝弓和滑动三种型号。三种型号的颊面管在转矩角和补偿角的设计上、主弓丝孔高度h(有0.018”(0.46mm)和0.022”(0.56mm)上有区分。
颊面管按使用牙位可分为:6牙位颊面管和7牙位颊面管。其中6牙位颊面管由上右牙(16)、上左牙(26)、下左牙(36)和下右牙(46)一共4颗产品组成一套完整的产品;7牙位颊面管同样由上右牙(17)、上左牙(27)、下左牙(37)和下右牙(47)一共4颗产品组成一套完整的产品。
修改后:增加了规格型号列表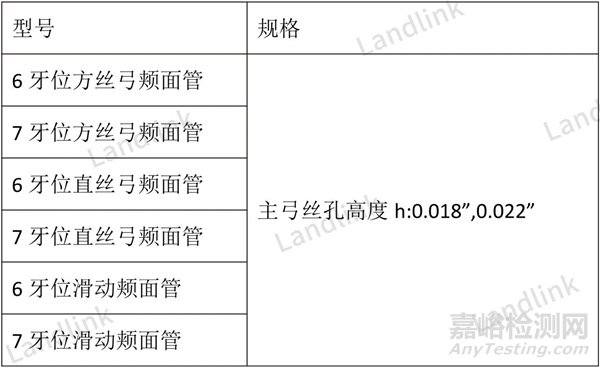
对于更复杂的的产品列表,也可以采用目前主流大厂采用的给每个规格都编码的形式。如美敦力,威高等公司的植入物规格型号表就是这样设计的。
(四)规格间结构存在差异,缺少图示
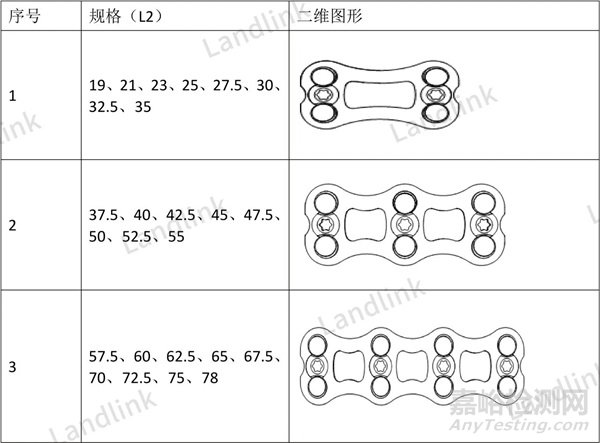
在说明型号间区别时,必要时应当以辅以图片(二维图、三维图)直观明了地展示不同型号间的区别,需要注意的是相同型号不同规格间可能也存在分组设计的特征,以下面颈椎前路钉板为例,同一个型号不同规格的节段数量有不同的设计,通常情况下,节段数量会被认为是比较重要的设计特征,是需要在注册资料中披露出来的。
第二部分:性能对比
性能对比的发补主要存在以下几个方面:
1.尺寸对比不全
2.规格型号选择不合理
3.测试方法不合理
(一)尺寸对比不全
关于尺寸的对比,需要单独列表进行说明。包括关键尺寸,关键尺寸的范围目前趋势来看已经变得越来越大。除了倒角,圆角这些轮廓修饰尺寸外,其它诸如螺钉大小径,螺距,牙型角,长度,特别是配合尺寸,能提供的都需要提供。
另外申报产品的规格范围不能超出对照品,关于这一点,FDA在关于510k注册实质等同的说明上也做了同样的说明。
(二)性能对比的规格型号选择不合理
1.未选择力学最差情况,在进行力学分析时需要逐性能分析。典型的例子是螺钉的旋入旋出和自攻应选取最大规格,轴向拔出力和断裂选取最小直径。
2.未覆盖不同结构设计,比如固定钛板和可调钛板的力学性能需要分别研究。

3. 未对测试数据进行最基本的统计分析,目前国内注册通常只需要提供均值,标准差这些就行,很少会被要求提供进一步的统计分析,如双样本分析。
(三)测试方法不合理
1.很多时候验证项目没有标准的测试方法,制造商就以此为由不提供相应的对比研究,审评员常常会要求制造商合理开发研究方法。
2.避免有限元分析的最差位置与实物测试破坏的位置不一致。
3.力学研究时作用力的加载方向是否和临床使用时一致。
第三部分:性能定义
性能定义方面主要存放以下发补问题:
1.尺寸公差标注不合理
2.性能、尺寸定义不全
3.组件尺寸不符合技术要求
4.指标定义不科学
(一)尺寸公差标注不合理
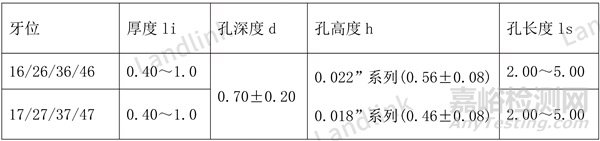
以下表正畸颊面管的尺寸标注为例,表1修改前厚度和长度写的是范围,而且范围很大,不符号机加工的尺寸控制特点,这种审评老师是不认可的。
表1 修改前
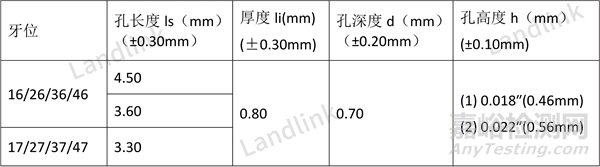
修改后,每个尺寸都设置了公差,且将公差范围放在了表头,这更加符合通常的表达格式。
表2 修改后
(二)尺寸定义不全
植入物,穿刺类产品均需要标注粗糙度,人体组织贴合面,齿槽等均需分别控制粗糙度,新企业往往忽略这个要求。
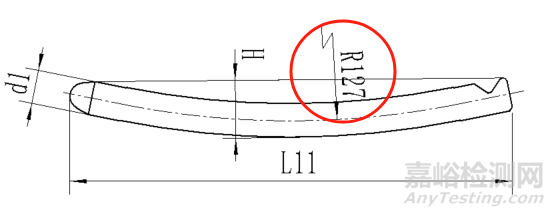
尺寸需要尽可能标注的全,但是可以不检验,如下图红圈中的半径。
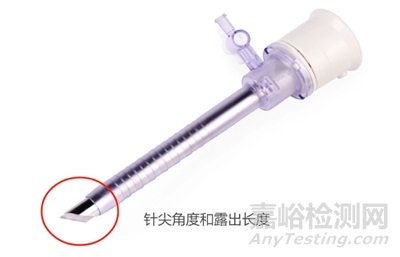
关键尺寸,影响产品功能的尺寸需要送检,如下图穿刺针的针尖露出长度和针头的刃口角度。
(三)组件尺寸不符合产品技术要求
很多产品的组件是外购件,这些外购件往往供应商统一了尺寸。如果这类组件的尺寸最终在产品技术要求上也出现,就格外要小心,曾经就出现过供应商提供的带袢钛板的线圈尺寸范围未被技术要求完全覆盖的情形,存在严重的产品不合格隐患。要知道,在国内抽检查到的尺寸不符合技术要求是要停产整改的,后果极其严重。
供应商线圈长度 mm
制造商线圈长度 mm
15±2.5(12.5~17.5)
16±2(14~18)

(四)指标定义不科学
力学性能往往采用测试等同对比产品然后进行分析的方式,很多厂家会计算出均值的95%分位数的值,然后又乘以一个内部自定义的安全系数后作为技术要求的指标,层层降低标准。这种做法高概率被审评员驳回。直接通过合理的测试然后计算95%分位数作为指标就行了。
金属植入物产品往往有阳极氧化工艺,会引入新元素,技术要求上需要说明表面元素类型,只能写阳极氧化氧化液自身携带的元素。
第四部分:临床评价
根据我们老师过往的经验,发现国内临床评价关注点基本聚焦在性能对比表上。性能对比不全是主要问题。
性能对比的差异分析要尽可能说没有实质性差异,针对有差异部分,必须给出不降低临床安全有效性的结论,这点非常重要。我们在一型呼吸机临床评价报告上,总共有100页差异分析,最终结论为有差异的只有10余条,而整个临床评价报告中关于临床文献和不良数据检索不到10页,我们在该型临床评价报告上实现了0发补。
另外在一个注册单元中包含了太多的对比产品,对审评老师和注册文件编写人员都是极其不友好的。这会大大增加对比分析的难度。
临床评价是一项复杂的系统工程,需要丰富的产品经验,不同的产品需要分别对待。

来源:Internet


