您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-20 10:47
今日,第一三共(Daiichi Sankyo)宣布其与阿斯利康(AstraZeneca)联合开发的重磅抗体偶联药物(ADC)Enhertu(trastuzumab deruxtecan)获得美国FDA授予突破性疗法认定(BTD),用于治疗激素受体(HR)阳性HER2低表达(IHC 1+或IHC 2+/ISH-)或HER2超低表达(定义为带有膜染色的IHC 0)不可切除或转移性乳腺癌患者,这些患者接受过两线内分泌疗法治疗其转移性疾病,或在接受一线内分泌疗法联合CDK4/6抑制剂后6个月内或在接受内分泌辅助疗法后24个月内发生疾病进展。此外,第一三共也同时宣布欧洲药品管理局(EMA)已接受Enhertu新适应症的监管申请,将针对Enhertu作为单药治疗不可切除或转移性HER2低或超低表达成年乳腺癌患者进行评估,这些患者至少接受过一次内分泌疗法治疗转移性疾病。
乳腺癌是最常见的癌症之一,也是全球癌症相关死亡的主要原因之一。据统计,2022年全球确诊乳腺癌病例超过200万,死亡人数超过66.5万。HER2是一种酪氨酸激酶受体生长促进蛋白,在包含乳腺癌等多种类型的肿瘤细胞表面表达。HER2表达水平高(IHC 3+或IHC2+/ISH+)的患者被归类为HER2阳性,并接受HER2靶向疗法治疗,约占所有乳腺癌的15%至20%。在过去,未被归类为HER2阳性的肿瘤被归类为HER2阴性,尽管这些肿瘤中许多仍然带有一定程度的HER2表达。据估计,大约60%至65%的HR阳性、HER2阴性乳腺癌为HER2低表达,另外25%可能为HER2超低表达肿瘤。目前没有专门针对HER2超低表达患者的靶向疗法获得批准。
这次美国FDA授予BTD以及EMA接受监管申请,主要是基于DESTINY-Breast06试验的积极数据。这是一项全球性、随机、开放标签的3期试验,旨在评估Enhertu(5.4 mg/kg)与研究者选择的化疗对HR阳性、HER2低或超低表达的晚期或转移性乳腺癌患者的疗效和安全性。受试者均未接受过针对晚期或转移性疾病的化疗,并且接受过至少两线内分泌疗法治疗转移性疾病。如果患者在转移性环境中接受过一线内分泌疗法联合CDK4/6抑制剂,并且在一线治疗后6个月内,或在接受过内分泌辅助疗法后24个月内出现疾病进展,他们也符合入组条件。该试验共招募了866例患者,包含713名HER2低表达,以及153名HER2超低表达患者。
DESTINY-Breast06试验的主要分析显示:
在HER2低表达患者中,与化疗相比,Enhertu通过盲法独立中心审查(BICR)将疾病进展或死亡风险降低了38%(HR=0.62;95% CI:0.51-0.74;p<0.0001)。Enhertu组的中位无进展生存期(PFS)为13.2个月,而化疗组为8.1个月。
在整体试验人群中,Enhertu与化疗相比,疾病进展或死亡风险降低了37%,中位PFS为13.2个月,而化疗组为8.1个月(HR=0.63;95% CI:0.53-0.75;p<0.0001)。
此外,预定的探索性分析显示,在HER2低表达和HER2超低表达患者中,患者PFS的临床显著改善表现一致。在HER2超低表达患者中,Enhertu将疾病进展或死亡风险降低了22%,中位PFS为13.2个月,而化疗组为8.3个月(HR=0.78;95% CI:0.50-1.21)。在Enhertu组中观察到13例完全缓解,包括9例HER2低表达患者。在HER2超低表达亚组中,Enhertu组有4例完全缓解,而在化疗组中没有观察到完全缓解。详细数据请见下表:
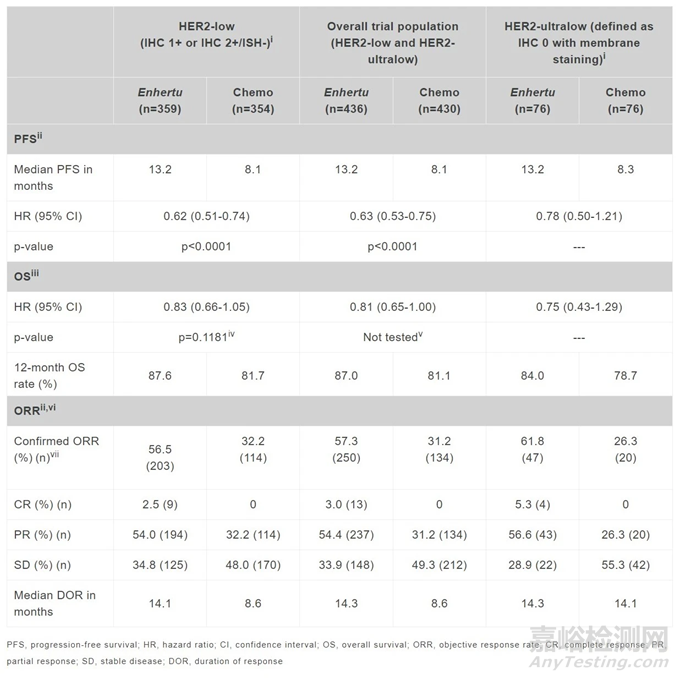
▲DESTINY-Breast06试验的数据总结(图片来源:参考资料[3])
Enhertu是阿斯利康和第一三共联合开发的ADC疗法。它采用第一三共专有的DXd ADC技术平台设计,由靶向HER2的人源化单克隆抗体通过四肽可裂解连接子,与拓扑异构酶1抑制剂有效载荷连接组成。Enhertu在2019年首次获美国FDA批准,用以治疗无法切除或转移性HER2阳性乳腺癌患者。今年4月,FDA批准该疗法用于治疗不可切除或转移性HER2阳性实体瘤成年患者,这些患者已接受过先前治疗且缺乏满意的替代治疗选项。之前新闻稿指出,Enhertu是首款具有不限癌种适应症的HER2靶向ADC疗法。
直至目前为止,Enhertu已获得8项BTD,其中4项是针对转移性乳腺癌。除了这次新授予的BTD之外,之前乳腺癌相关的3项BTD分别是针对后线HER2低表达转移性乳腺癌、二线HER2阳性转移性乳腺癌和后线HER2阳性转移性乳腺癌。Enhertu还获得了另外4项BTD,包括针对HER2阳性转移性实体瘤、HER2阳性转移性结直肠癌、HER2突变转移性非小细胞肺癌(NSCLC)和HER2阳性转移性胃癌。
除了共同开发Enhertu,阿斯利康和第一三共也共同开发Trop2靶向ADC datopotamab deruxtecan(Dato-DXd)。美国FDA在这个月接受两家公司所递交该疗法的生物制品许可申请,用于治疗无法切除或转移性HR阳性、HER2阴性乳腺癌成人患者,这些患者已接受过前期全身治疗。
除了与阿斯利康进行合作以外,第一三共也在去年10月与默沙东(MSD)就该公司的三个ADC候选药物:patritumab deruxtecan(HER3-DXd)、ifinatamab deruxtecan(I-DXd)和raludotatug deruxtecan(R-DXd)达成了全球开发和商业化协议,将在全球范围内共同开发和潜在商业化这些候选ADC疗法。

▲Enhertu(DS-8201)结构示意图(图片来源:参考资料[4])
ADC是新药开发的热点领域之一,近年多家大药企通过并购或授权协议在这一领域加码布局。去年3月,辉瑞(Pfizer)以430亿美元收购了ADC先驱公司Seagen以扩展其肿瘤学管线。去年12月,艾伯维(AbbVie)以总额达约101亿美元收购ImmunoGen,获得其“first-in-class”抗体偶联药物Elahere(mirvetuximab soravtansine)。今年1月,强生(Johnson & Johnson)斥资高达约20亿美元收购Ambrx Biopharma,囊获其分别靶向前列腺特异性膜抗原(PSMA)与HER2的抗体偶联药物ARX517与ARX788。宜联生物(MediLink Therapeutics)也在同月宣布与罗氏(Roche)达成全球合作和许可协议,将合作开发靶向间质表皮转化因子(c-MET)的下一代ADC候选产品YL211(c-MET ADC),用于治疗实体瘤。
此外,在研ADC的开发也呈爆发式增长趋势。根据摩根士丹利(Morgan Stanley)公司去年发布的一项报告,目前至少有1400项ADC的临床试验正在进行中。
参考资料:
[1] ENHERTU® Granted Breakthrough Therapy Designation in U.S. for Certain Patients with HER2 Low or HER2 Ultralow Metastatic Breast Cancer. Retrieved August 19, 2024 from https://www.businesswire.com/news/home/20240818195338/en
[2] ENHERTU® Type II Variation Application Validated by EMA for Patients with HER2 Low or HER2 Ultralow Metastatic Breast Cancer Following At Least One Endocrine Therapy. Retrieved August 19, 2024 from https://www.businesswire.com/news/home/20240818615324/en
[3] Enhertu demonstrated a median progression-free survival of 13.2 months in HR-positive, HER2-low and HER2-ultralow metastatic breast cancer following one or more lines of endocrine therapy. Retrieved June 2, 2024, from https://www.astrazeneca.com/media-centre/press-releases/2024/Enhertu-demonstrated-median-progression-free-survival-thirteen-months.html
[4] Global Pharma Innovator with Competitive Advantage in Oncology. Retrieved April 5, 2024, from https://www.daiichisankyo.com/files/investors/library/materials/2020/pdf/20210113%E2%80%97JPM%20Conference.pdf

来源:药明康德


