您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-24 10:27
摘要:截至2020年,文献作者记录了共有9款ADC药物获得商业化批准,而目前这一数字已上升至15款。这些药物无一例外地采用了化学偶联技术进行生产。在这些获批的ADC中,有7种药物因其广泛的药物分布特性而受到市场的关注。特别值得一提的是,2019年,第一三共成功将首款位点特异性ADC引入市场,标志着位点特异性偶联技术在ADC领域的研究者中日益受到青睐。
本文重点讨论了当前ADC生产的偶联方法并对其中三种常用偶联工艺进行了比较。
抗体偶联药物概述
抗体偶联药物 (ADC) 通常由四部分组成,包括单克隆抗体,细胞毒性有效载荷,连接子和偶联位点。
单克隆抗体在ADC药物的设计中扮演着关键角色,其对肿瘤相关抗原的高亲和力为药物提供了精确的靶向能力。与此同时,有效载荷的毒性杀伤作用是实现治疗效果的另一大支柱。通过精心设计的连接子,单抗和有效载荷在适宜的偶联位点相连,共同构成了一个高效且具有特定靶向性的ADC药物。
连接子和偶联化学在生产稳定且有效的ADC药物中扮演着核心角色。一方面,偶联位点的共价键必须具备足够的稳定性,以确保ADC在形成后能够保持稳定,并在治疗过程中展现出良好的体内药代动力学特性。另一方面,连接子在内化至靶细胞后,必须能够有效地释放其携带的有毒有效载荷,以实现对肿瘤细胞的精准杀伤。
药物-抗体比例(DAR)是评估ADC药物性能的一个关键指标,它对药物的疗效和安全性起着决定性作用。DAR值过高可能导致ADC在生产过程中出现聚集现象,并可能在体内的清除速度加快,从而降低治疗效果。相反,DAR值过低的ADC可能面临疗效不足的问题,因为未偶联或低药物负载的抗体可能会与靶抗原发生竞争。不同的ADC对最佳DAR值的需求各异,因此,精确获得和控制这一比例是ADC药物开发企业必须掌握的关键能力。
有前景的偶联方法既有利于生产临床中有效安全的ADC药物,也有利于建立精简的ADC生产工艺,作者对已应用于大规模生产的偶联方法进行了总结,重点强调高生产率,可放大和稳健的偶联工艺。

表 1. FDA审批通过的ADC药物 (该表截至原文献作者2020年发文时的统计数据。目前已有15款ADC药物上市,除了表中9款之外还有Rakuten Medical的Akalux,ADC Therapeutics的Zynlonta,荣昌生物的Akalux,Seagen/Genmab的Tivdak,ImmunoGen的Elahere;AstraZeneca的Lumoxiti于2018年FDA approve,2023年撤市)
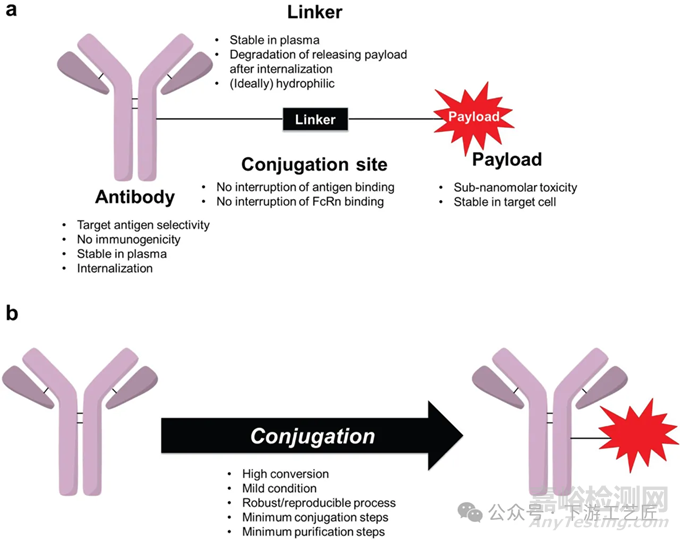
图 1. (a) ADC各组成部分的要求, (b) ADC偶联工艺的要求
偶联方法分类
总体上ADC生产中的偶联方法可以做如下分类:
第一类是天然赖氨酸偶联或半胱氨酸偶联。
第二类是抗体工程化技术通过在抗体分子中引入半胱氨酸残基或非天然氨基酸残基,为有效载荷的结合提供了特定位点的反应标签。这种创新方法最初在2008年被报道,它使得ADC的开发能够实现更高程度的位点特异性。目前,利用此技术开发的某些ADC药物正在进行人体临床试验,展现出应用前景。然而,该方法也面临一些挑战,例如,合适的插入位点的选择增加了早期ADC设计的复杂性,并可能在抗体的细胞培养和生产过程中引入额外的难题。
第三类是使用酶催化偶联。利用酶催化的位点特异性修饰技术,可以精确地在抗体上引入所需的化学基团,从而生产出具有均一DAR值的ADC。这种技术能够确保药物分子与抗体的稳定且均匀的结合,提高ADC的疗效和安全性。然而,这一方法也面临着一些挑战。首先,所使用的酶本身也是一种蛋白质,如果其物理化学性质与单克隆抗体相似,可能会在纯化过程中引入额外的复杂性。其次,将酶作为生产过程中的关键原材料,需要制定全面的化学、制造和控制(CMC)策略,以确保生产过程的一致性和可重复性。
化学偶联之随机偶联ADC
传统的随机化学偶联方法基于使用抗体中天然存在的氨基酸残基进行非选择性修饰,例如天然赖氨酸 (图2a) 和还原的链间天然半胱氨酸 (图2b) 。
1.天然赖氨酸偶联
偶联工艺简介:药物-抗体比例(DAR)是评估ADC药物性能的重要指标,它对药物的疗效和安全性起着决定性作用。DAR值过高可能导致ADC在生产过程中聚集,且在体内的清除速度加快,而DAR值过低则可能影响药物的疗效,因为未偶联或低药物负载的抗体可能与靶抗原发生竞争。不同的ADC可能具有不同的最佳DAR值,精确地获得和控制这一最佳值是ADC药物开发企业必须掌握的关键能力。
特点和缺陷:药物-抗体比例(DAR)是评估ADC药效和安全性的重要指标。DAR值过高可能导致ADC在体内聚集并加快清除速率;而DAR值过低可能影响药物的疗效,因为未偶联或低药物负载的抗体可能与靶抗原发生竞争。不同的ADC可能具有不同的最佳DAR值,因此,精确获得和控制这一最佳值是ADC开发企业必须掌握的关键能力。对于通过天然赖氨酸残基进行偶联的ADC,由于天然IgG1分子具有约80个赖氨酸残基,合成的ADC是具有不同DAR值的混合物。例如,T-DM1(Kadcyla)就是这种情况。因此,利用天然赖氨酸进行偶联需要付出巨大努力,以建立一个能够重复生产具有一致有效载荷分布和DAR值的稳健生产工艺。
2.天然半胱氨酸偶联
偶联工艺简介:药物-抗体比例(DAR)是评估ADC药物性能的重要指标,其值的高低对药物的疗效和安全性具有显著影响。DAR值过高可能导致ADC在生产过程中出现聚集现象,且在体内的清除速率加快,而DAR值过低则可能影响药物的疗效,因为未偶联或低药物负载的抗体可能会与靶抗原发生竞争。不同的ADC药物对最佳DAR值的需求各异,因此,精确获得和控制这一最佳值是ADC药物开发企业必须掌握的关键能力。
特点和缺陷:与通过赖氨酸残基进行偶联的方法相比,天然半胱氨酸偶联的ADC展现出了更为可控的DAR值和较低的产品异质性,尽管实现精确的DAR值仍面临挑战。因此,这种方法已成为当前ADC合成的主流技术。然而,该技术仍需进一步优化。例如,使用三(2-羧乙基)膦(TCEP)进行还原时,若在37℃下未进行适当优化,可能会导致产品出现浑浊和聚集现象。此外,抗体的反应活性与其等电点(pI)密切相关,这使得建立一个普适的金标准变得复杂。
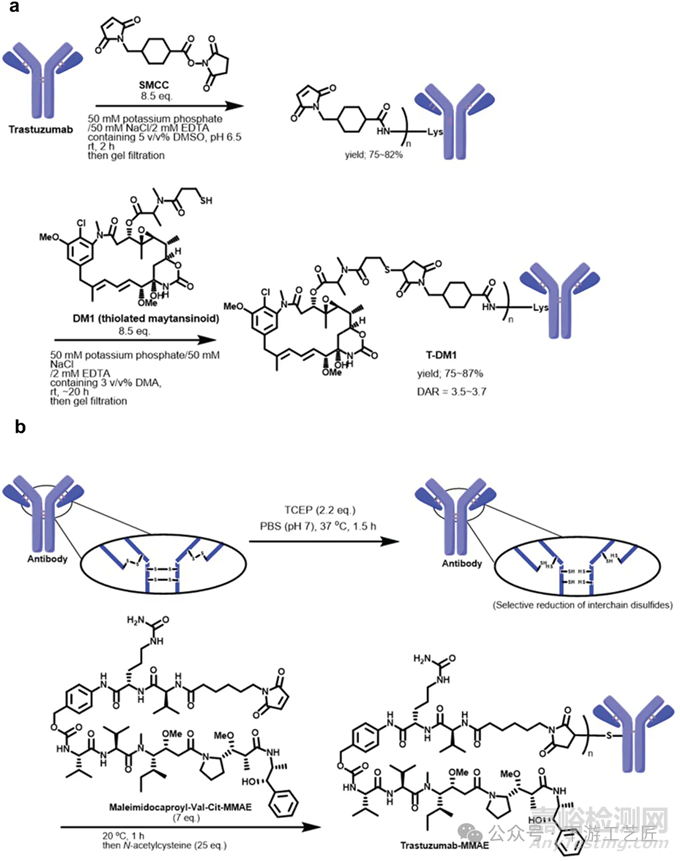
图 2. (a) T-DM1的合成工艺, (b) Trastuzumab-MMAE的合成工艺
化学偶联之位点特异性偶联ADC
近年来,众多科学家投身于生物相容性生产技术的研究,目的是制造出位点特异性ADC,这被认为能够显著增强药物的临床治疗窗口。尽管这一领域取得了显著进展,但只有少数技术成功跨越了从实验室研究到工艺开发和规模化生产的鸿沟。
1.高DAR值ADC
尽管高DAR值的ADC可能展现出对癌细胞更强的杀伤力,但它们的药代动力学特性和全身性暴露往往不尽如人意。例如,高DAR值的ADC可能更容易被免疫系统清除,或者由于更强的疏水性而倾向于聚集。为了克服这些障碍,研究人员正在探索额外的技术来生产位点特异性的高DAR值ADC,如通过引入亲水性连接子来改善其物理化学和生物特性。
案例一:第一三共的突破性药物Enhertu采用了一种创新的药物-连接子结构设计,以解决传统抗体药物偶联物(ADC)在DAR8状态下常遇到的疏水性挑战。该药物利用依沙替康衍生物作为有效载荷,并通过一种四肽(GGFG)连接子与靶向抗体稳定连接。此连接子在血液循环中具有高度稳定性,并能在ADC靶向至肿瘤后被特定的酶精确裂解,从而增强了ADC的稳定性并提高了治疗效率。
案例二:Trodelvy,由吉利德公司开发的一种高效ADC,通过其每个Trop-2抗体连接多达8个SN38分子,实现了高DAR值。该药物的连接子由七个短链的亲水性PEG单元构成,这种设计不仅减少了ADC制备过程中的聚集趋势,还提升了药物的溶解性和稳定性。一旦ADC被细胞内化,连接子中的碳酸酯键在细胞内的酸性pH条件下迅速裂解,释放出SN-38,从而在肿瘤细胞内发挥其细胞毒性效应。
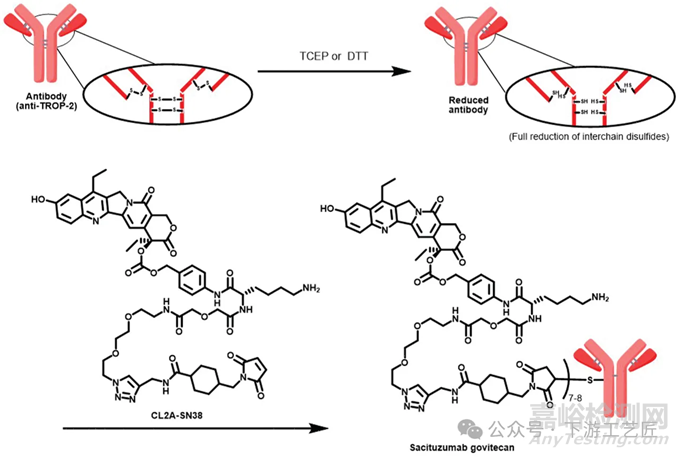
图 3. sacituzumab govitecan-hziy的合成工艺
2.天然半胱氨酸重桥接
半胱氨酸重桥接是一个两步过程,利用一组串联的Michael/Retro-Michael反应将天然抗体转变为位点特异性ADC(图 4)。
尽管高DAR值的ADC可能展现出更强的癌细胞杀伤力,但其药代动力学特性和全身性暴露往往不尽如人意。例如,高DAR值的ADC可能更容易被免疫系统清除,或者由于更强的疏水性而倾向于聚集。为了克服这些挑战,研究人员正在开发能够生产位点特异性高DAR值ADC的额外技术,如引入亲水性连接子以改善其物理和生物特性。
位点特异性ADC的开发提供了一种生产具有低异质性DAR4的ADC的方法,这些ADC具有改善的物理和生物特性,得益于合适的亲水间隔物的引入。该转化过程从完整抗体到ADC的效率高,范围在70-95%之间。所需的试剂为小分子量的还原剂和带有亲水间隔物的药物接头,这些试剂可以通过切向流过滤(TFF)轻松去除,简化了偶联和纯化过程。
桥接位点特异性方法因其简单性和高效性而在化学文献中得到了广泛报道。特别是在抗体的位点特异性偶联反应中,有效的双烷基化试剂,如溴亚甲基吡咯酮、二硫代马来酰亚胺、二溴吡嗪二酮或芳基二丙腈等,已被证明能够提高偶联效率。这些试剂的使用也表明ADC的DAR值是可控的,可以根据需要调节。
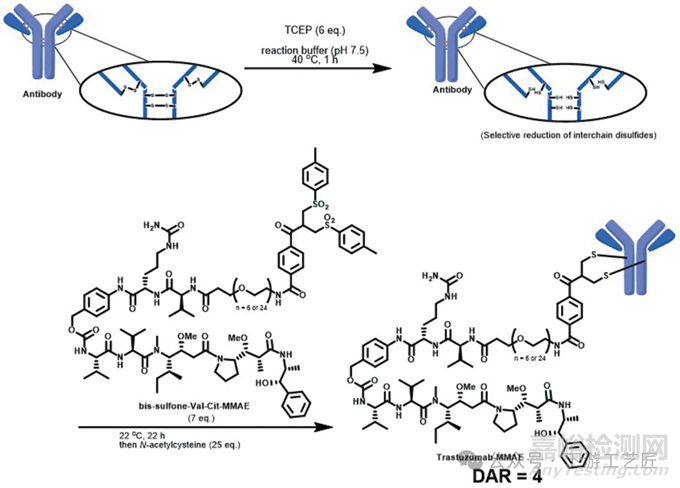
图 4. 基于半胱氨酸重桥接的trastuzumab-MMAE合成工艺
3. Fc亲和肽结合
蛋白A,一种源自细菌的小分子蛋白,因其对抗体的特异性亲和力而受到研究者的青睐。基于这一特性,研究者通过改造获得了具有更高亲和力的肽段,例如对Z结构域的改造,以及被称为Fc III的17个氨基酸残基的肽段,后者能够特异性地结合人IgG1的Fc片段。利用这些亲和化合物进行化学偶联,即亲和标记,已成为实现位点特异性修饰的有前景的方法之一。
Ajinomoto公司开发了一种创新的肽基试剂,该试剂含有可裂解的连接子,并将其应用于一种先进的无痕标记技术,命名为AJICAP®。通过这项技术,公司成功地证明了其位点特异性ADC在动物模型中展现出显著的疗效(参见图5)。合成策略包括将含有活性酯的亲和肽试剂特异性地与曲妥珠单抗的Fc区域Lys 248位点结合,形成曲妥珠单抗与肽的共轭物。随后,通过还原切割抗体与肽之间的二硫键连接物,并利用DHAA进行再氧化,以生成含有硫醇的抗体。最终,这些硫醇基团与商业化的MC-VC-MMAE进行反应,成功合成了AJICAP®-ADC。
这种称为第一代AJICAP®的 ADC 生产工艺由一个简单的程序组成,其中包含一个TFF纯化步骤,而无需引入制备色谱进行纯化。
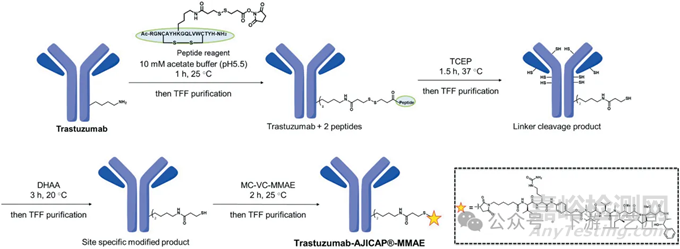
图 5. 基于第一代AJICAP的trastuzumab-MMAE合成工艺
三种化学偶联工艺的优缺点比较
作者对三种化学定点偶联方法进行了优缺点比较。
高DAR值偶联:此技术展现出在制造稳定性和生产历史方面的明显优势,其已被应用于市售ADC药物的制造,并且通过细致的调整和优化,有望扩展至其他ADC产品的生产。尽管如此,所期望的药物-抗体比率(DAR)与药物连接子的相容性可能会面临挑战。以传统的药物连接子MC-VC-MMAE为例,如果不进行结构上的重新设计和改进,其高疏水性可能导致分子聚集,从而阻碍实现高DAR值的偶联。此外,高DAR值的ADC可能仅通过较弱的非共价键连接其重链和轻链,这可能构成一个潜在的缺陷。连接区域缺乏二硫键可能对ADC的物理化学特性产生不利影响,已有研究指出,例如sacituzumab govitecan-hziy,其抗体依赖性细胞介导的细胞毒性(ADCC)活性显著降低。
天然半胱氨酸重桥接:此技术在偶联条件上展示了卓越的适应性,通过简单地更换双烷基化试剂,便能轻松调节所需的药物-抗体比率(DAR)。与传统的硫醇-马来酰亚胺化学偶联相比,半胱氨酸重桥接避免了逆迈克尔反应的风险,后者可能导致连接子-有效载荷在血液循环中过早释放,引发不利的生物效应。然而,半胱氨酸重桥接技术也存在潜在的缺陷,即可能形成一些非预期的“错误桥接”ADC。不过,通过采用创新的双烷基化试剂和优化的偶联工艺,这一问题有望得到有效解决。
Fc亲和肽结合:Fc亲和肽技术展现出了在多种抗体和药物接头应用中的巨大潜力。与传统方法相比,此技术能够实现位点特异性的DAR2 ADC,无需依赖于亲水性连接子或双烷基化试剂。尽管该技术在合成过程中需要较长的步骤,但近期Ajinomoto公司的研究人员通过工艺优化,有望克服这一挑战。
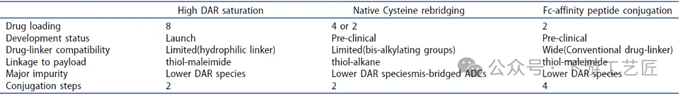
表 2. 三种化学位点特异性偶联方法的比较
未来发展方向
位点特异性偶联:相较于传统的高异质性随机偶联ADC,位点特异性ADC和具有均匀DAR值的ADC在组成和分析上展现出了更高的简便性,预示着其市场需求将不断增长。
偶联后纯化方法:为了满足对特定DAR值ADC的特定需求,可能需要采用色谱纯化技术来分离具有特定DAR值的ADC组分。目前,可扩展的高效离子交换色谱-高效液相色谱(HIC-HPLC)纯化方法正在积极开发中,并且已经识别出适合药物接头疏水性的合适树脂材料。同时,提高纯化过程中的回收率也是当前研究的一个重要焦点。
偶联分子形式多样化:未来ADC领域的发展趋势将包括利用多样化的分子形式,如双特异性抗体和Fc融合蛋白等。然而,由于这些分子的复杂性,某些ADC构建体在生产过程中可能面临稳定性的挑战。因此,开发特定的偶联条件以适应这些复杂结构的ADC构建体,将是实现其稳定生产的关键。
复杂分子提高对偶联的要求:本综述指出,目前广泛采用的偶联技术多依赖于TCEP介导的二硫键还原步骤。然而,面对下一代高度工程化的抗体,如对氧化还原状态敏感的双特异性抗体,现有方法可能面临挑战。因此,未来研究可能需探索不依赖于二硫键还原的位点特异性偶联策略。这包括开发非共价结合的ADC技术、基于色氨酸或酪氨酸的选择性偶联方法,以及利用金属催化进行抗体标记的新型反应。

来源:Internet


