您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-08-26 13:02
口服溶液的工艺相对简单,一般分为配制、过滤和灌装。口服溶液剂放大生产中常出现的问题一般与其特有的性质有关。如:(1)为提高原辅料的溶解性,常添加有机试剂,如乙醇、丙二醇等,这种情况首先需确认生产设备是否带有防爆系统。(2)为提高口服溶液的粘滞性(黏度),处方中常添加增稠剂,这种黏度的增加可能对过滤和灌装有一定的挑战。(3)为提高产品的适口性,常添加香精类的矫味剂。香精的加入方式和溶解温度可能影响后续产品的性状。(4)为确保产品在储存和使用中的微生物符合要求,一般添加抑菌剂。在放大中需要特别关注某些抑菌剂的溶解温度,其直接影响抑菌剂的溶解度和溶解速度。
配制过程中常见的问题
(一)含有机试剂处产品的要求
在口服溶液的开发中,常因原料药或辅料的溶解性能不佳,添加一些有机试剂,常见的有丙二醇、甘油、乙醇等。当产品中使用了乙醇,需要特别注意乙醇在产品中的比例,以及产品需要在车间放大的批量。根据HB/T20698-2000化工采暖通风与空气调节设计规定:生产车间内乙醇在空气中爆炸浓度下限按容积计3.1%,按重量计59克/立方米。
假设配制间的空间为75m3,那在生产中乙醇的用量则不能超过59g/m3*75m3=4.425kg(一般情况,审查的时候都以处方中乙醇用量全部挥发去计算)。当我们的批生产量为1000L时,处方中乙醇的比例则不能超过0.44%。若处方中超过这个浓度,建议在防爆车间生产或减少批量。
(二)辅料的溶解
为增加口服溶液的黏度,处方中常用的高分子材料有黄原胶、明胶、海藻酸钠、羟乙基纤维素、羟丙甲纤维素、环糊精等。此类高分子材料一般具有较强的亲水性,一般都需要充分的分散后才能溶解完全,避免出现溶解不完全的现象(外部透明内部发白的小团块)。
在生产中,我们要针对所用高分子材料的性质去选择合适的分散方式。当羟乙基纤维素作为增稠剂时,一般先用有机溶剂(如乙醇)分散后,再加入冷水中溶解。若处方中不便加入乙醇等有机试剂,则可能需要借助球磨机或均质机分散后再加入药液中。切勿因小试阶段溶解现象佳,忽略放大中的风险。
羟丙甲纤维素作为增稠剂时,需先在水中将羟丙甲纤维素高温条件下(≥60℃)分散后再降温溶解(≤50℃)。若将分散温度提高至90℃以上,HPMC溶解后更澄清,产品的性状更佳。
(三)香精的加入温度
在口服溶液的开发中,常添加各种香精来提高产品的适口性,首先需对香精中的小分子醛和醇类做安全性评估,还需要关注香精中的基质(溶解各种芳香醛的溶剂)。建议可以优先选择与处方中溶剂相似的基质,如处方中含有一定比例的乙醇,建议选择乙醇基质的香精。原因如下:
在某一口服溶液的开发中,我们选择与原研气味一致的葡萄香精,因处方中有5%的乙醇。对比了在产品中分别添加乙醇和丙二醇基质的葡萄香精的性状。结果发现,加了乙醇基质香精的样品澄清度明显优于丙二醇基质的,推测因丙二醇被稀释后,香精中的芳香醛溶解度下降所致。
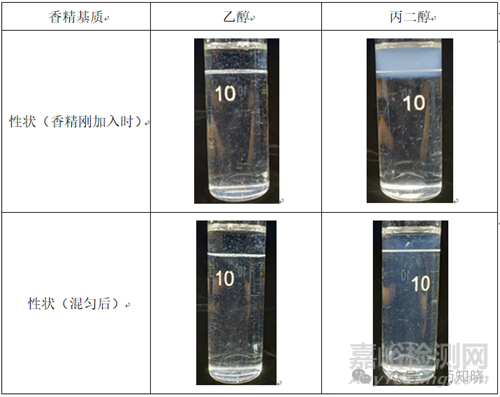
在放大过程中,香精的加入温度尽量控制在室温加入(一般≤30℃),一方面是减少芳香醛的挥发而影响适口性。另一方面,也是避免香精的基质挥发,导致某些芳香醛类的物质溶解度降低,影响产品的性状。
(四)抑菌剂的溶解温度
在口服溶液中常使用一种或多种抑菌剂来确保产品在储存和使用过程中的微生物稳定性,且抑菌剂的含量也被要求定入质量标准内。常见的难溶性的防腐剂有山梨酸、羟苯甲酯、羟苯乙酯和羟苯丙酯等。在产品开发中,对于羟苯酯类的抑菌剂,一般要先高温溶解(70℃以上)后再加入其它物料。
在放大生产中,要充分了解抑菌剂在不同温度下的平衡溶解度,避免在某一降温步骤抑菌剂析出。
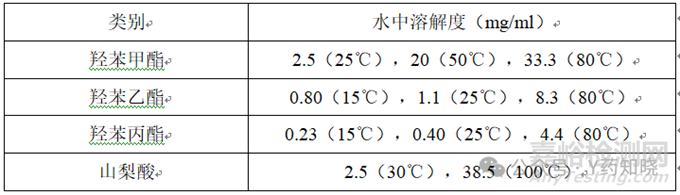
在某一口服溶液的开发中,羟苯酯类抑菌剂的占比在其溶解度以下,但工艺步骤中,第一步的底水量为50%,加热溶解抑菌剂时候,抑菌剂处于过饱和状态。此时,应继续在保温状态下加入其他辅料或者溶剂。避免直接降温后放置过长时间(>30min)抑菌剂的析出,且析出后的抑菌剂在后续工艺中很难再溶解。
过滤中常见的问题
在讨论口服溶液的滤器如何选择时,首先要了解国内法规的要求及实际生产中的需求,明确过滤目的后,方可选择合适的滤器。
首先《化学药品仿制药口服溶液剂药学研究技术指导原则》里(后续简称指导原则),没有对口服溶液如何过滤或滤器孔径做明确的规定。但指导原则在处方工艺开发部分提到“应采用适宜的措施控制产品中的微生物负荷并保证贮藏过程中稳定,通过工艺验证拟定合理的生产时长”,也提到,“基于风险评估的结果,参考相关指导原则酌情进行过滤器、管路类(如硅胶管)及密封件等直接接触药液组件的相容性研究”。不难看出,审评方是认同口服溶液需要进行过滤的。
其次,我们在多数口服溶液的开发中,所用的辅料都是普通药品级,若不经过滤工序,得到的产品很难满足指导原则中对口服溶液“澄清度(浊度不大于0.5号的浊度液)”的要求。
基于以上两点,同时,因为口服溶液会添加一定的防腐剂,或者本身含有较高浓度的糖分也会起到一定的抑菌作用,对微生物初始水平控制有一定的帮助。因此,我们在口服溶液的开发中设定过滤工序的主要目的是为了去除物理杂质,保证溶液的澄清度。其次合适的过滤方式对微生物的负荷也能起到积极的作用。
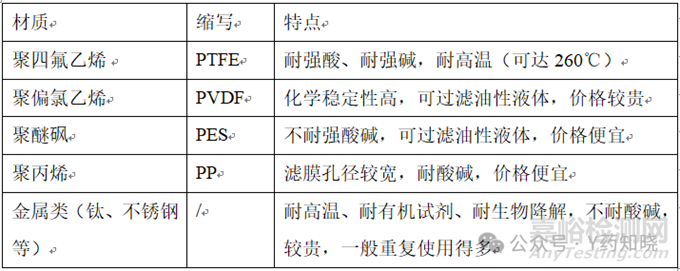
实际选择过滤方式时,需要根据药液的性质(处方种类、黏度、过滤前药液澄清度等),依次对滤器的材质、孔径、尺寸、串联方式逐步确认。常用的几种材质的滤器见下表。
如:某一口服溶液的处方组成为:API、磷酸、磷酸钠、山梨醇、甘油、羟苯乙酯、羟苯丙酯、薄荷香精和乙醇(约5%),pH值范围3.5~5.5,药液黏度约30cps。
因该产品有机试剂占比较低,偏弱酸性,因此与所有滤膜材质的相容性风险均较低,一般会选择价格相对便宜的PES、PP或者金属类的滤器。同时结合实验室过滤时>1微米时,药液的澄清度不佳。因此,滤膜的孔径优选0.45微米。
该产品的黏度相对水的黏度(约1.0cps)较高,放大的批量1000L相对较大,结合产品过滤时的速度要满足后续灌装的速度方可持续性生产,因此我们在实验室需要测试0.45微米3种不同材质的滤膜通量。
在测试通量前,需要确保实验中单位滤膜面积的药液处理量要远大于放大中单位滤膜面积的药液处理量,确保实验室的配制量能够真实地评估滤膜的通量,因为实际生产时的流速可能不是恒定,随着过滤而越来越低。
放大中单位滤膜面积的药液处理量=批量/滤芯面积
实验中单位滤膜面积的药液处理量=配制量/滤膜面积
实验室膜通量=过滤体积(ml)/(时间(min)*滤膜面积(m2)*过滤压力(MPa))
放大中理论膜通量=灌装速度(瓶/min)*灌装体积(ml/瓶)/(滤膜面积(m2)*过滤压力(MPa))
经过测试,确认了0.45微米PP和0.45微米的钛棒滤芯可以满足生产需求,因钛棒滤芯单只价格昂贵,一般都重复使用,对滤芯的清洁方法要求比较高。因此最终选择10寸的PP材质滤芯。若此次测试中,膜通量均不满足生产需求,我们可以将滤芯尺寸提高至20寸,也可以两支10寸滤芯并联使用,以增加滤器的有效过滤面积。若本品实验室未出现1微米以下澄清度不佳的情况,还可通过提高滤器孔径来提高膜通量。避免出现生产中灌装至一半时滤器堵塞的情况。
灌装中的精度问题
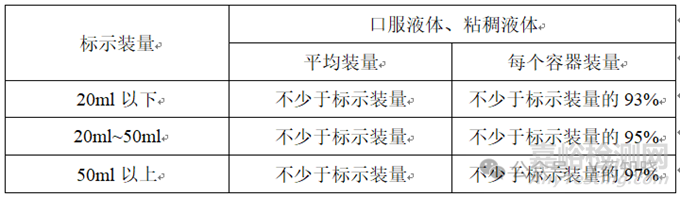
根据2020年版《中国药典》四部要求,对于不同体积的口服溶液,灌装量的要求如下表。
口服溶液的灌装机原理主要有:(1)常压法灌装:在大气压下,利用流体的自身重力灌装,适用于不含气的低粘度流体;(2)真空法灌装:在低于大气压条件下灌装,适用于黏度稍大一点的液体;(3)压力法灌装:借助机械或气液压装置控制活塞往复运动,适用于黏度较大的液体,也是应用最广的灌装法之一。
在实际生产中,若药液的基质为甘油、丙二醇等,可能会使药液黏度高达500cps。需要特别关注不同灌装设备的灌装精度,一般通过调节灌装设备都能使产品达到相应的装量要求,但精度差可能导致液位线偏上,药液粘附于容器口外壁,导致旋盖时产品的密封性差。

来源:药知晓