您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-29 15:57
1、临床试验备案与审批的区别
所有临床试验均需备案,部分医疗器械多一个临床试验审批步骤。
临床试验审批通过(如需),在组长单位通过伦理审查后,申请人再向所在地省局进行临床试验备案。
关于临床试验相关,GCP法规解读,可以参考往期内容:
GCP法规解读—第一章&第二章
GCP法规解读—第三章&第四章
GCP法规解读—第五章&第六章
GCP法规解读—第七章&第八章 &第九章
审批和备案的区别如下:
1、临床试验审批
仅适用于需要进行临床试验审批的医疗器械。资料报送给国家局。
关于需要临床试验审批的器械目录,以及审批流程及要求,可以参考上期内容:医疗器械临床试验-审批流程及要求
2、临床试验备案
适用于所有需要进行临床试验的医疗器械,包括需要进行临床试验审批的医疗器械。资料报送给省局。
2、临床试验备案的流程及要求
1、法规依据
1、《医疗器械监督管理条例》
第二十六条
2、《医疗器械注册与备案管理办法》
第三十七条
2、备案流程
参考省局的办事指南,可以选择窗口办理、网上办理,快递申请,流程如下:
1、准备备案资料
按省局要求准备备案文件,以北京局为例,主要包括:北京市依申请政务服务事项告知承诺书、临床试验备案表、伦理委员会意见(最少有组长单位)、申办者与临床试验机构实施临床试验协议或合同、医疗器械临床试验批件(如有)、申办者或代理人营业执照(正副本,正本原件提供,进行查验)、授权委托书。
2、提交备案资料
向省局提交备案资料,备案成功后,有三种方式获取医疗器械临床试验备案表:窗口领取、邮寄送达、网站下载。
备案表范本:
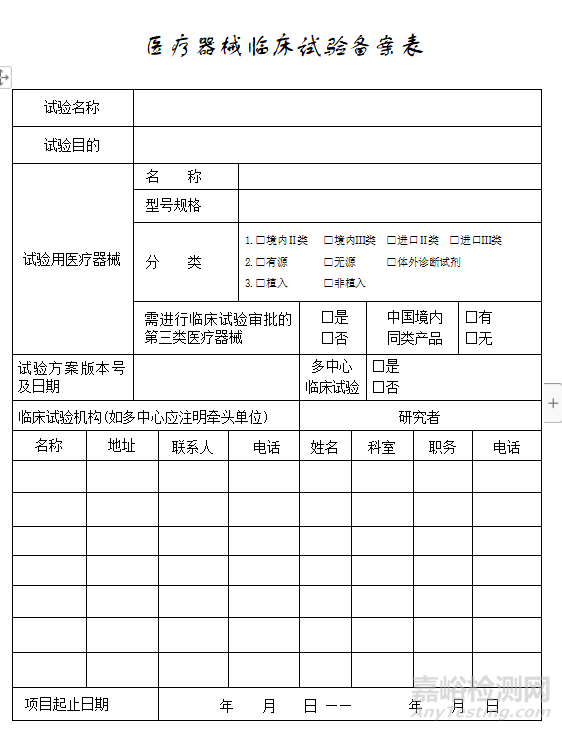
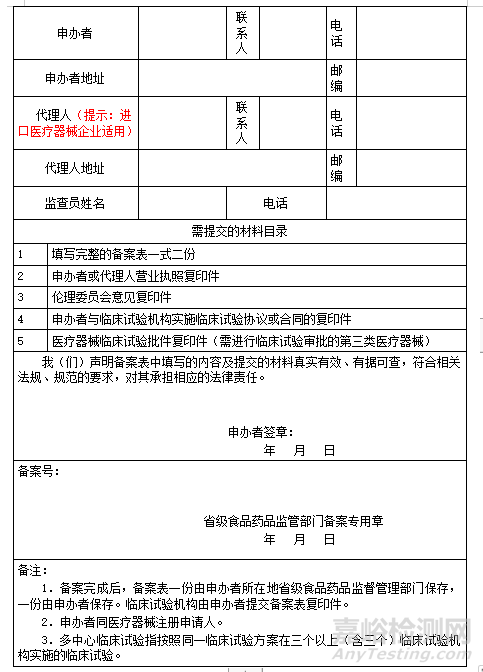
3、更新备案信息
临床试验过程中,备案表上信息发生变化,申办者应该按首次备案的流程及时向省局更新备案信息,获取更新后的备案表。

来源:医械铁锅炖