您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-24 20:34
摘 要: 建立超高效液相色谱-三重四级杆串联质谱法同时测定增乳膏中6种成分(盐酸水苏碱、王不留行黄酮苷、盐酸益母草碱、芍药苷、阿魏酸、毛蕊花糖苷)。样品经甲醇超声提取,采用Waters XBridge BEH C18色谱柱分离,流动相为乙腈-0.1%甲酸水溶液,流量为0.3 mL/min,柱温为30 ℃,进样体积为2 μL。采用电喷雾电离源(ESI源)、正负离子同时监测、多反应监测(MRM)模式扫描。6种成分在各自质量浓度范围内与对应色谱峰面积呈良好的线性关系,相关系数均不小于0.999 8,方法检出限为0.035~0.535 ng/mL,定量限为0.100~1.605 ng/mL。样品加标平均回收率为98.08%~103.11%,测定结果的相对标准偏差为1.94%~3.67%(n=6)。该方法适用于同时测定增乳膏中6种成分的含量,可为增乳膏的质量标准修订提供参考。
关键词: 增乳膏; 超高效液相色谱-串联质谱法; 盐酸水苏碱; 王不留行黄酮苷; 盐酸益母草碱; 芍药苷; 阿魏酸; 毛蕊花糖苷
增乳膏是由王不留行、通草、熟地黄、当归、白芍、川芎、益母草、天花粉8味中药材组成的中药复方制剂[1],具有补血活血、通络催乳的功效[2],主治妇女产后气血虚弱所致的乳汁不行。盐酸水苏碱、盐酸益母草碱、王不留行黄酮苷、芍药苷、阿魏酸及毛蕊花糖苷为《中华人民共和国药典》中上述各味药材的质量控制成分。随着现代分析仪器的发展进步,中药复方制剂正在从传统的单一指标检测发展到多指标检测[3]。增乳膏现行国家药品标准[WS-5163(B-0163)—2014Z]中,仅采用高效液相色谱(HPLC)法测定芍药苷的含量,目前尚无多成分检测的报道。色谱-质谱联用技术集色谱的高分离能力和质谱的高专属性于一体,具有选择性强、灵敏度高、分离能力好等优点[4],在多组分同时检测方面相比二极管阵列检测器具有明显的优势[5],近年来已广泛应用于中药复方制剂的定量分析[6]。笔者建立超高效液相色谱-三重四级杆串联质谱(UPLC-MS/MS)法同时测定增乳膏中盐酸水苏碱、王不留行黄酮苷、盐酸益母草碱、芍药苷、阿魏酸、毛蕊花糖苷6种成分的含量,可以为增乳膏的质量控制提供科学依据。
1、 实验部分
1.1 主要仪器与试剂
超高效液相色谱-三重四级杆串联质谱仪:Waters XEVO TQ-S型,沃特世科技(上海)有限公司。
电子分析天平:(1)XS204型,感量为0.1 mg;(2)XPR205/A型,感量为0.01 mg,梅特勒-托利多国际贸易上海有限公司。
超声波清洗仪:KQ-600VSM型,昆山市超声仪器有限公司。
对照品:盐酸水苏碱(质量分数不小于99.2%)、王不留行黄酮苷(质量分数不小于97.1%)、盐酸益母草碱(质量分数不小于98.1%)、芍药苷(质量分数不小于94.6%)、阿魏酸(质量分数不小于99.4%)、毛蕊花糖苷(质量分数不小于95.2%),中国食品药品检定研究院。
乙腈、甲醇:均为色谱纯,德国默克股份联合公司。
增乳膏样品:漳州片仔癀药业股份有限公司。
实验用水:蒸馏水,屈臣氏集团(香港)有限公司。
1.2 仪器工作条件
1.2.1 色谱仪
色谱柱:Waters XBridge BEH C18色谱柱[100 mm×2.1 mm,2.5 μm,沃特世科技(上海)有限公司];柱温:30 ℃;流动相:乙腈-0.1%(体积分数)甲酸水溶液(体积比为18∶82),流量为0.3 mL/min;进样体积:2 μL。
1.2.2 质谱仪
离子源:ESI源;监测模式:正负离子同时监测;扫描模式:MRM模式;离子源温度:150 ℃;毛细管电压:0.5 kV;脱溶剂气温度:500 ℃;脱溶剂气流量:1 000 L/h;各目标成分的质谱参数见表1。
表1 目标成分质谱参数
Tab. 1 Mass spectrometry parameters of target components
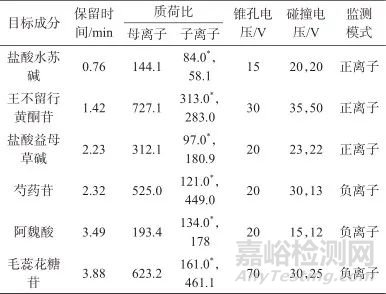
注:带*号的为定量离子。
1.3 样品处理
取增乳膏约5 g,精密称定,加适量甲醇于100 mL容量瓶中,超声处理30 min (功率为300 W,频率为40 kHz),冷却后用甲醇定容至标线,摇匀,以4 000 r/min转速离心5 min,精密吸取上清液1 mL,置于100 mL容量瓶中,用甲醇定容至标线,摇匀,过滤,取续滤液,制得样品溶液。
1.4 溶液配制
单成分对照品储备液:精密称取盐酸益母草碱对照品10.34 mg、阿魏酸对照品10.72 mg及毛蕊花糖苷对照品10.17 mg,分别置于100 mL棕色容量瓶中,用甲醇溶解并定容至标线,精密吸取上述溶液各1 mL,分别置于100 mL棕色容量瓶中,用甲醇定容至标线,分别制成质量浓度为1.014 4 μg/mL的盐酸益母草碱溶液、1.065 6 μg/mL的阿魏酸溶液和0.968 2 μg/mL的毛蕊花糖苷溶液。精密称取对盐酸水苏碱照品11.11 mg、芍药苷照品12.02 mg,分别置于100 mL棕色容量瓶中,用甲醇溶解并定容至标线,分别制成质量浓度为110.211 2 μg/mL的盐酸水苏碱溶液、113.709 2 μg/mL的芍药苷溶液。精密称取王不留行黄酮苷对照品11.02 mg,置于200 mL棕色容量瓶中,用甲醇溶解并定容至标线,制成质量浓度为53.502 1 μg/mL的王不留行黄酮苷溶液。
混合对照品溶液:分别精密吸取单成分对照品储备液盐酸水苏碱溶液2 mL、王不留行黄酮苷溶液0.5 mL、盐酸益母草碱溶液5 mL、芍药苷溶液2 mL、阿魏酸溶液5 mL、毛蕊花糖苷溶液1.5 mL,置于同一只50 mL棕色容量瓶中,用甲醇定容至标线,摇匀,制成含盐酸水苏碱4.408 4 μg/mL、王不留行黄酮苷0.535 0 μg/mL、盐酸益母草碱0.101 4 μg/mL、芍药苷4.548 4 μg/mL、阿魏酸0.106 6 μg/mL、毛蕊花糖苷0.029 0 μg/mL的混合对照品溶液。
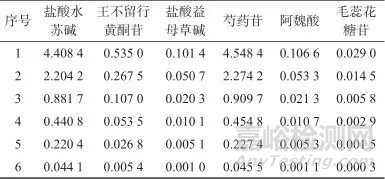
系列混合对照品溶液:精密吸取混合对照品溶液0.5、2.5、5、10、25、50 mL,分别置于50 mL容量瓶中,用甲醇定容至标线,摇匀,配制成系列混合对照品溶液,各溶液的质量浓度见表2。
表2 系列混合对照品溶液质量浓度
Tab. 2 The mass concentration of series mixed reference solution ( μg/mL )
1.5 实验方法
取系列混合对照品溶液及样品溶液,按1.2仪器工作条件进样分析,记录色谱峰面积,按外标法计算增乳膏中6种成分的含量。
2、 结果与讨论
2.1 提取溶剂和提取时间选择
分别选择甲醇、体积分数为50%的甲醇水溶液、体积分数为70%的甲醇水溶液为提取溶剂,分别超声提取30、45、60 min,考察增乳膏中6种成分的提取效果。结果表明,相同超声时间下,甲醇的提取效果最好,30 min即可提取完全,故选择甲醇为提取溶剂,提取时间为30 min。
2.2 流动相选择
分别考察甲醇-0.1%(体积分数,下同)甲酸水溶液、甲醇-0.1%甲酸水溶液(含5 mmol/L甲酸铵)、乙腈-0.1%甲酸水溶液及乙腈-0.1%甲酸水溶液(含5 mmol/L甲酸铵) 4种流动相体系。结果表明,在甲醇-0.1%甲酸水溶液和甲醇-0.1%甲酸水溶液(含5 mmol/L甲酸铵)流动相体系中,盐酸益母草碱、王不留行黄酮苷和毛蕊花糖苷色谱峰形较差且峰宽较大,而在乙腈-0.1%甲酸水溶液和乙腈-0.1%甲酸水溶液(含5 mmol/L甲酸铵)流动相体系中,各待测成分响应均较高,色谱峰形良好,由于甲酸铵对离子响应的提高作用不大,且容易对仪器造成污染,因此选择乙腈-0.1%甲酸水溶液作为流动相。
2.3 质谱条件优化
通过查阅盐酸水苏碱、盐酸益母草碱[7‒9]、王不留行黄酮苷[10]、芍药苷[11‒12]、阿魏酸[13‒15]、毛蕊花糖苷[16]相关文献及调谐质谱参数,选择响应较大、色谱峰形较好的离子对及参数作为各成分的定量离子对和定性离子对,优化结果见1.2.2。
2.4 专属性试验
取混合对照品溶液及样品溶液,按1.2仪器工作条件进样分析,结果显示,样品溶液各成分色谱峰形良好,对应色谱峰保留时间与相应对照品溶液一致,无其他干扰,专属性良好。混合对照品溶液及样品溶液的MRM色谱图如图1所示。
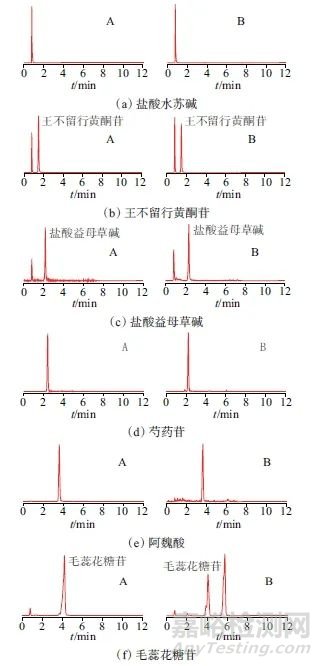
图1 混合对照品溶液及样品溶液MRM色谱图
Fig. 1 MRM chromatograms of mixed reference solution and sample solution
A—混合对照品溶液;B—样品溶液
2.5 线性方程、检出限与定量限
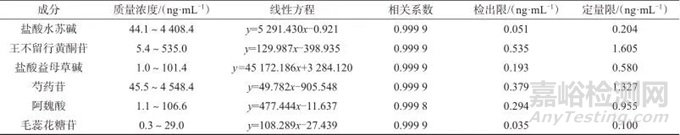
按1.2仪器工作条件测定系列混合对照品溶液,记录色谱峰面积。以各对照品溶液的质量浓度为横坐标(x),色谱峰面积为纵坐标(y),进行线性回归,计算线性方程和相关系数。
将各单成分对照品储备液不断稀释,按1.2仪器工作条件进样分析,以信噪比为3∶1时的质量浓度为各成分的检出限;信噪比为10∶1时的质量浓度为各成分的定量限。各成分质量浓度线性范围、线性方程、相关系数、检出限及定量限见表3。
表3 质量浓度线性范围、线性方程、相关系数、检出限及定量限
Tab. 3 Linear range of mass concentration,linear equation,correlation coefficient,detection limit and quantitative limit
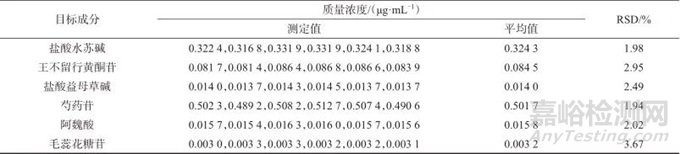
2.6 精密度试验
精密称取同一批增乳膏样品(编号S1),按1.3方法平行制备6份样品溶液,并按1.2仪器工作条件进样测定,结果见表4。由表4可知,盐酸水苏碱、王不留行黄酮苷、盐酸益母草碱、芍药苷、阿魏酸、毛蕊花糖苷测定结果的相对标准偏差分别为1.98%、2.95%、2.49%、1.94%、2.02%、3.67%,表明方法精密度良好。
表4 精密度试验结果
Tab. 4 Results of precision test
2.7 稳定性试验
取同一增乳膏样品(编号S1)溶液,分别于室温放置0、2、4、6、8、12、24 h后进样测定,结果见表5。由表5可知,盐酸水苏碱、王不留行黄酮苷、盐酸益母草碱、芍药苷、阿魏酸、毛蕊花糖苷测定结果的相对标准偏差分别为0.21%、1.41%、0.99%、2.11%、2.52%、3.51%,表明样品溶液在室温条件下24 h内稳定性良好。
表5 稳定性试验结果
Tab. 5 Results of stability test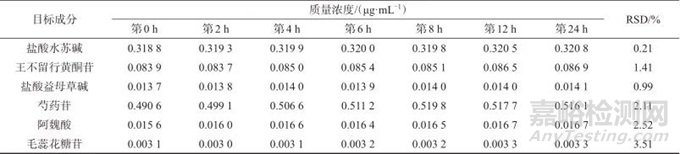
2.8 样品加标回收试验
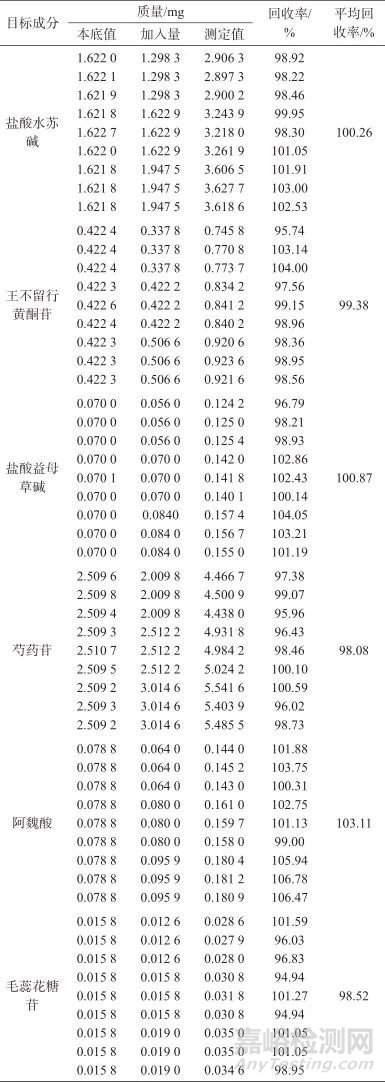
精密称取9份已知含量的增乳膏样品(编号S1)各约2.5 g,精密称定,分别加入相当于各目标成分已知量的80%、100%、120%的对照品,每个水平各3份,按1.3方法制备加标样品溶液,并按1.2仪器工作条件进样测定,结果见表6。由表6可知,各目标成分的加标平均回收率为98.08%~103.11%,表明该方法准确度良好。
表6 加标回收试验结果
Tab. 6 Results of spiked recovery test
3、 结语
建立超高效液相色谱-三重四级杆串联质谱(UPLC-MS/MS)法可以同时测定增乳膏中6种成分的含量。该方法稳定、可靠、简便快捷,弥补了增乳膏现行国家药品标准[WS-5163(B-0163)—2014Z]只检测单一成分的不足,可为增乳膏的质量标准修订提供参考。
参考文献:
1 吴丽璇.高效液相色谱法测定增乳膏中芍药苷的含量[J].中国药师,2009,12(9):1 259.
WU Lixuan. Determination of paeonifiorin in Zengru Ointment by HPLC[J]. China Pharmacist,2009,12(9):1 259.
2 郑金华,何玉婷,罗秀针.增乳膏治疗产后缺乳疗效Meta分析[J].社区医学杂志,2020,18(16):1 165.
ZHENG Jinhua,HE Yuting,LUO Xiuzhen. Meta analysis of the effect of Zengru Gao treating postpartum breast milk deficiency[J]. Journal of Community Medicine,2020,18(16):1 165.
3 赵冬青.中药复方制剂的质量控制方法探讨[J].中医药管理杂志,2022,30(3):200.
ZHAO Dongqing. Exploration of quality control methods for traditional Chinese medicine compound preparations[J]. Journal of Traditional Chinese Medicine Management,2022,30(3):200.
4 张黎媛.液质联用技术在中药质量控制中的应用[J].世界中医药,2018,13(2):513.
ZHANG Liyuan. Research progress on the quality control of chinese herbal medicine by liquid chromatography coupled with mass spectrometry[J]. World Chinese Medicine,2018,13(2):513.
5 祁昆,王洋,陈涛,等.液质联用在中药复方制剂研究中的应用[J].天津中医药大学学报,2017,36(5):396.
QI Kun,WANG Yang,CHEN Tao,et al. Application of LC-MS in the research of traditional Chinese medicine prescriptions[J]. Journal of Tianjin University of Traditional Chinese Medicine,2017,36(5):396.
6 王迪,俞佳,詹固,等.液质联用技术在中药研究中的应用进展[J].中华中医药学刊,2022,40(2):68.
WANG Di,YU Jia,ZHAN Gu,et al. Advances in application of liquid chromatography-mass spectrometry technology in study of traditional chinese medicine[J]. Chinese Archives of Traditional Chinese Medicine,2022,40(2):68.
7 谭亚杰,濮宗进,唐于平,等.基于UPLC-QTRAP®/MS2方法评价不同干燥方式对益母草中化学成分的影响[J].中草药,2019,50(7):1 576.
TAN Yajie,PU Zongjin,TANG Yuping,et al. Effects of different drying methods on multiple chemical components in Leonurus japonicus based on UPLC-QTRAP®/MS2[J]. Chinese Traditional and Herbal Drugs,2019,50(7):1 576.
8 周超,张聿梅,何轶,等. HPLC-MS法同时测定益母草及其颗粒剂中盐酸水苏碱与盐酸益母草碱的含量[J].药物分析杂志,2016,36(5):830.
ZHOU Chao,ZHANG Yumei,HE Yi,et al. Simultaneous contents determination of stachydrine hydrochloride and leonurine hydrochloride in Herba Leonuri and Yimucao granules by HPLC-MS[J]. Chinese Journal of Pharmaceutical Analysis,2016,36(5):830.
9 宋珊,郭红丽,康江鹏. HPLC-ESI-MS/MS同时测定八珍益母丸中9种有效成分[J].中草药,2019,50(2):402.
SONG Shan,GUO Hongli,KANG Jiangpeng. Simultaneous determination of nine bioactive components in Bazhen Yimu Pills by HPLC-ESI-MS/MS[J]. Chinese Traditional and Herbal Drugs,2019,50(2):402.
10 赵志国,张晓梦,张敏敏,等. HPLC-DAD-ESI-TOF/MS鉴别和测定前列欣胶囊中多种成分及其多指标定量指纹图谱研究[J].药物分析杂志,2017,37(10):1 810.
ZHAO Zhiguo,ZHANG Xiaomeng,ZHANG Minmin,et al. Identification and determination of multiple components in Qianliexin capsules by HPLC-ESI-TOF/MS and study on the quantitative fingerprint[J]. Chinese Journal of Pharmaceutical Analysis,2017,37(10):1 810.
11 吴丹,王静,刘龙,等. UPLC-MS/MS法同时检测参芪健胃颗粒中芍药苷、橙皮苷、甘草酸铵的含量[J].中国医药导刊,2020,22(10):698.
WU Dan,WANG Jing,LIU Long,et al. Determination of paeoniflorin,hesperidin,ammonium glycyrrhizinate in shenqi jianwei granules by UPLC-MS/MS[J]. Chinese Journal of Medicinal Guide,2020,22(10):698.
12 郑敏霞,陈喆,刘培,等.白芍中芍药苷及其衍生物的UPLC-MS/MS分析[J].中国中药杂志,2011,36(12):1 641.
ZHENG Minxia,CHEN Zhe,LIU Pei,et al. Analysis and identification of glycosides in Paeonia lactiflora by UPLC-MS/MS[J]. China Journal of Chinese Materia Medica,2011,36(12):1 641.
13 路千里,郑茶凤. HPLC-MS/MS法同时测定天麻头风灵胶囊中天麻素、阿魏酸、哈巴俄苷及肉桂酸的含量[J].沈阳药科大学学报,2014,31(12):984.
LU Qianli,ZHENG Chafeng. Simultaneous determination of gastrodine,ferulic acid,harpgoside and cinnamic acid in Tianma Toufengling capsule by HPLC-MS/MS[J]. Journal of Shenyang Pharmaceutical University,2014,31(12):984.
14 任园宇,魏东伟,孙武勇,等. HPLC-MS法测定高温胁迫前后玉米幼苗6种酚酸类化合物含量[J].化学研究与应用,2020,32(5):795.
REN Yuanyu,WEI Dongwei,SUN Wuyong,et al. Determination of six phenolic compounds in corn seedlings before and after high temperature stress by HPLC-MS[J]. Chemical Research and Application,2020,32(5):795.
15 林敏. HPLC-MS/MS法同时测定丹栀逍遥丸中六个成分的含量[J].海峡药学,2021,33(12):74.
LIN Min. Simultaneous determination of six constituents in Danzhi Xiaoyao Pills by HPLC-MS/MS[J]. Strait Pharmaceutical Journal,2021,33(12):74.
16 张波泳,江振作,王跃飞,等. UPLC/ESI-Q-TOF/MS法分析鲜地黄、生地黄、熟地黄的化学成分[J].中成药,2016,38(5):1 104.
ZHANG Boyong,JIANG Zhenzuo,WANG Yuefei,et al. Analysis of chemical constituents in fresh,dried and prepared Rehmanniae Radix by UPLC/ESI-Q-TOF/MS[J]. Chinese Traditional Patent Medicine,2016,38(5):1 104.
引用本文: 黄淑芬 . 超高效液相色谱-三重四级杆串联质谱法同时测定增乳膏中6种成分[J]. 化学分析计量,2024,33(9):22. (HUANG Shufen. Simultaneous determination of six components in Zengru Gao by UPLC-MS/MS[J]. Chemical Analysis and Meterage, 2024, 33(9): 22.)

来源:化学分析计量


