您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-15 07:57
一、背景
奥泽沙星(Ozenoxacin)最早是由日本富山化学株式会社(Toyama)发现的一种新型的、不含氟的喹诺酮类抗菌药物。该药物后经日本玛路弘株式会社(Maruho)开发成奥泽沙星洗剂(规格:2%,商品名:Zebiax® Lotion)和2%奥泽沙星乳膏剂(规格:2%,商品名:Zebiax® Oily Cream, W/O型油性乳膏),分别于2015年和2021年在日本上市,适应症均为浅表性皮肤感染和痤疮(伴有化脓性炎症)。
2014年,一家名为Ferrer Internacional的西班牙制药公司与Toyama达成独家许可协议,获得了奥泽沙星在世界范围内的(除中国、日本、韩国以及中国台湾地区以外)的独家许可。2017年12月,美国FDA 批准了该公司研发的奥泽沙星乳膏剂(规格:1%,商品名:XEPI®)上市,用于治疗成人以及年龄在两个月及以上的幼儿因感染金黄色葡萄球菌或化脓性链球菌而产生的脓疱病(Impetigo)。
XEPI®的内容物为淡黄色的乳膏,共有3种包装规格,分别为10克、30克以及45克,每克乳膏中含有10毫克的奥泽沙星(1% w/w),辅料包括苯甲酸、辛基十二醇、油酰聚氧乙烯甘油酯、聚乙二醇-7 硬脂酸酯、丙二醇、纯化水、硬脂醇。
二、药物简介
奥泽沙星治疗脓疱病的作用机制为抑制致病菌(金黄色葡萄球菌、化脓性链球菌)的DNA复制酶、DNA旋转酶A以及拓扑异构酶IV,从而发挥治疗作用。

图1 奥泽沙星的化学结构式
奥泽沙星的化学结构式如图1所示,分子式为C21H21N3O3,分子量363.41,其物理化学性质见总结于表1。
表1 奥泽沙星的物理化学性质

三、1%奥泽沙星乳膏剂处方浅析及制备工艺
根据FDA说明书及公开的相关制剂专利(专利号:US9180200 B2),1%奥泽沙星乳膏剂(规格:1%,商品名:XEPI®)的处方组成及其用量如表2所示。
聚乙二醇-7 硬脂酸酯(Tefose® 63)是一种O/W型非离子乳化剂,HLB值为9.5,在该处方中起到乳化剂的作用。Tefose®63是由硬脂酸的PEG-6酯和棕榈酸及硬脂酸的乙二醇酯和PEG-32的硬脂酸酯按一定的比例组成的混合物,外观为蜡状固体。由于该辅料在生产后是将其融化后灌装到容器中,在冷却和结晶过程中产品会发生分层导致容器中的各成分分布不均匀,因此在使用该辅料之前,为了保证称取样品的均匀性,应在使用前将样品整体加热融化,搅拌均匀后使用,且由于其具有较宽的熔化范围(20-60℃),固加热温度建议控制在70℃-80℃。根据剂型以及目标粘度的不同,Tefose®63在处方中的用量可为5-20%。该辅料在外用制剂处方中常和油酰聚氧乙烯甘油酯(Labrafil® M 1944 CS)合用。
酰聚氧乙烯甘油酯(Labrafil® M 1944 CS)是一种W/O型非离子乳化剂,HLB值为4,是由油酸的单,双,三甘油酯以及PEG-6单,双酯组成的液体。在该处方中与Tefose®63合用能够增强其油水界面的乳化作用,提高处方的热稳定性(图2),起到助乳化剂的作用。一般来说,Tefose®63与Labrafil® M 1944 CS合用时的理想比例是2:1,但实际设计处方时可作相应的调整。
表2奥泽沙星乳膏剂(XEPI®)处方组成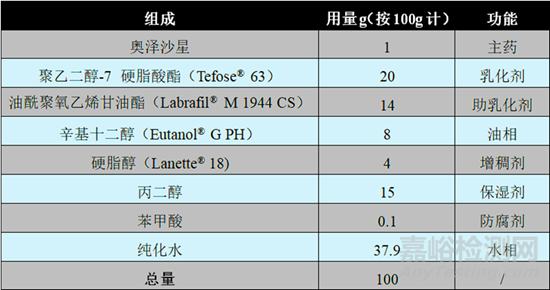
辛基十二醇为无色或偏黄的油性液体,是由两分子的癸醇缩合而成,对酸碱以及水解稳定,具有良好的稳定性,且作为辅料时一般被认为是安全无毒,无刺激性的。辛基十二醇常在化妆品和药物制剂中作为乳化剂和遮光剂,还具有润滑和润肤的作用,有研究还发现其具有促进药物经皮渗透的作用。该处方中,辛基十二醇主要作为油相分散主药。
硬脂醇又名十八醇,为白色蜡状、片状或者颗粒状的固体,在外用制剂中常作为增稠剂,可通过增加粘度提高制剂的稳定性,其对酸碱稳定,不易酸败,需要注意的是有些硬脂醇中的杂质可能导致接触性荨麻疹以及超敏反应。
丙二醇为无色粘稠状透明液体,在外用制剂中常用作保湿剂,用量约为15%,同样需要注意的是丙二醇可能会有一定的皮肤刺激性。
苯甲酸在外用制剂中常作为防腐剂,用量一般为0.1-0.2%,只有未解离状态下苯甲酸才能发挥抑菌作用,因此其抑菌效果取决于处方的pH值,最佳pH范围为2.5-4.5,而当pH大于5时,苯甲酸几乎没有抗菌活性。
依据奥泽沙星原研制剂XEPI®的专利(专利号:US9180200 B2),其制备过程是首先将丙二醇和纯化水加入容器中,于70-75℃加热搅拌;另将Tefose® 63、Labrafil®M 1944 CS、硬脂醇和苯甲酸于70-75℃加热融化后加入上述容器中,搅拌混合后高速剪切5分钟,得到空白乳液;另将奥泽沙星与辛基十二醇混合后于50-55℃加热,然后加入上述空白乳液中,搅拌混合后高速剪切20分钟;随后停止加热,使温度降至25-30℃,冷却后得到1%奥泽沙星乳膏。
四、1%奥泽沙星乳膏剂仿制药生物等效性评价
2022年10月,美国食品药品监督管理局(FDA)发布了奥泽沙星乳膏仿制药个药指南,指南中提供了两种BE研究方案,一种是体外终点BE研究,另一种是临床终点的BE研究。对于仿制药公司来说,后者需要投入大量的金钱和时间投入,因此体外终点BE研究显然更受欢迎。事实上,目前国内通过外用半固体一致性评价的产品中,也基本都是采用体外终点BE研究(见表3)。依据该FDA指南,若奥泽沙星乳膏仿制药产品处方中辅料种类(Q1)和用量(Q2)及物理性能与微观结构(Q3)和参比制剂相同或相似,且体外释放(IVRT)和体外透皮(IVPT)也相似,则无需进行昂贵的临床终点的BE研究。
表3 国内通过一致性评价的外用半固体制剂产品
依据FDA发布的奥泽沙星乳膏仿制药个药指南,1%奥泽沙星乳膏仿制产品的体外终点BE研究应包括以下四个方面:
第一,奥泽沙星乳膏仿制产品应在在辅料成分或处方的其他方面(可能会显著影响活性成分的局部或全身暴露的差异)应与参比制剂没有任何差异。受试制剂和参比制剂在辅料种类(Q1)和用量(Q2)上应相同,即仿制药辅料用量为参比制剂相应辅料用量的95%-105%。
第二,通过至少3个批的奥泽沙星乳膏仿制产品和3个批次(如有)参比制剂的可接受物理化学特性的对比研究,证明受试制剂和参比制剂具有相似的物理和结构(Q3)上的相似性。在批次的选择上,受试制剂和参比制剂的批次应最好选择在其货架期内不同阶段具有代表性的批次。具体的Q3研究内容要求参考最新版本的FDA行业指南Physicochemical and Structural (Q3) Characterization of Topical Drug Products Submitted in ANDAs。受试制剂与参比制剂的Q3比较应包括外观、相态及结构组织(提供有代表性的高分辨率显微镜图像、粒径分布、晶癖、多晶型、液滴粒径)、流变行为、pH值、比重以及其它相关的Q3属性。对于流变行为应进行以下评估:产品的剪切应力与剪切速率以及黏度与剪切速率的流动曲线,至少应该研究三种不同剪切速率(低、中、高)下产品的黏度数据;一个完整的不同剪切速率下的产品流动曲线,应该包括可达到的剪切速率范围内的多个数据点,直到确定低或高剪切平台;如果样品表现出塑性流动特性,应报告屈服应力值;应测量并报告线性粘弹性响应(存储和损耗模量与频率的对比)。
表4 奥泽沙星乳膏IVRT方法
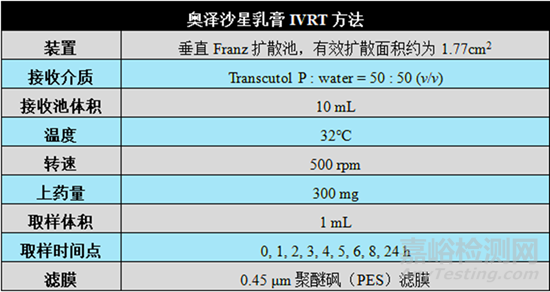
第三,应至少使用一批奥泽沙星乳膏仿制产品与参比制剂进行体外释放(IVRT)生物等效研究,IVRT方法应经过验证,二者释放速率应一致(计算受试制剂的中位体外释放率与参比制剂的中位体外释放率比值的90%置信区间,要求90%置信区间应在75% ~ 133.33%限度范围内)。关于IVRT研究的具体内容和要求参考最新版本的FDA行业指南In Vitro Release Test Studies for Topical Drug Products Submitted in ANDAs。FDA发布的针对奥泽沙星原研产品XEPI®的产品质量审评报告(Product quality review)中公布了其使用的IVRT方法,可供研究者参考(见表4)。
第四,应至少使用一批奥泽沙星乳膏仿制产品与参比制剂进行体外透皮(IVPT)生物等效研究,IVPT方法应经过验证,等效性的判断基于药物单位面积的最大渗透速率(Jmax)和总累积渗透量(AMT)。关于IVPT研究的具体内容和要求参考最新版本的FDA行业指南In Vitro Permeation Test Studies for Topical Drug Products Submitted in ANDAs。2014年,XEPI®原研公司Ferrer Internacional的研究者在Future Microbiology期刊上公开了该产品的IVPT方法,可供研究者参考(见表5)。
表5 奥泽沙星乳膏IVPT方法


来源:药事纵横


