您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-10-30 17:32
随着全球化的推进,制药行业面临着提升药品生产效率和质量的双重挑战。过程分析技术 (ProcessAnalytical Technology, PAT) 和连续制造技术 (Continuous Manufacturing, CM) 作为应对这一挑战的关键技术,正逐渐成为制药工业的新趋势。PAT 通过实时监测关键质量和性能属性,为药物生产过程的设计、分析和控制提供了创新的方法。而 CM 技术通过整合多个制药步骤,实现不间断生产,显著提高了生产效率和产品质量的一致性。本文综合分析了 PAT 和 CM 技术的优势、挑战及关键组成部分,并探讨了它们在药品监管和质量保证中的作用。最后,对未来 PAT 和 CM 技术的发展趋势进行了展望,包括技术整合与创新、数据驱动决策、监管科学进步、质量保证提升、生产灵活性和可扩展性、环境可持续性和个性化医疗的实现。这些技术的发展和应用将为制药行业带来深远的变革,提高生产效率,优化产品质量,并满足全球对高质量药品的不断增长的需求。
制药行业正经历快速的技术变革, 面临全球化、数字化和市场需求变化等多重挑战 [1-3]。在这一背景下,传统的药品生产方法和管理模式已无法满足现代社会对药品质量和生产效率的高要求。随着科技的不断进步,特别是在大数据、人工智能和智能制造领域的突破,制药行业开始探索更为灵活和高效的生产方式。批次生产是一个多步骤的过程, 在每个工艺步骤之后,生产通常会暂停以测量样品的质量,导致了物料在生产过程中进行了不必要的储存与转运。连续制造是在同一设施内实现不间断药物 制造的过程,各步骤之间没有停顿,通常也省略了中间体的离线测量。然而在具体实施过程中,连续投入的物料属性、工艺条件或环境因素可能存在瞬时工艺波动,传统的检验方法存在明显的滞后性问题,因此实时检测质量属性与调整操作参数极为关键。
采用质量源于设计 (Quality byDesign, QbD) 旨在确保药品质量可以在生产过程中自行设计,而无需进行密集的产品测试,从而规避药品工艺设计与制造过程的风险、提高科学性。在药品连续制造中实施 QbD 主要体现在全面的产品和工艺理解,这可以概括为对关键质量属性 (Critical Quality Attributes,CQA) 的监测。因此,制药 QbD 的基本要素包括识别关键过程参数 (CriticalProcess Parameter, CPP) 和关键材料属性 (Critical Material Attributes, CMA)及其与 CQA 的相关性。为了鼓励创新,提高对药品生产过程的控制,美国食品药品监督管理局 (Food and DrugAdministration, FDA) 于 2004 年提出了过程分析技术,目的是鼓励将 PAT 引入到药品生产和质量控制中,加强对药品生产过程的控制和理解,提高药品生产效率 [1]。FDA 鼓励的过程分析技术就是通过实时监控和过程控制策略使具有预定质量属性的产品达到一致性,PAT 框架大致分为 4 个部分:用于获得和分析数据的多变量工具;现代工艺过程分析技术;终点监控和工艺过程控制工具;持续性改进和信息管理工具。PAT 通过实时监测和控制生产过程中的CQA 及 CPP,使生产过程更加透明和可控,从而显著提高产品的一致性和质量保证。实施 PAT 可以进一步提高药品连续制造的产品质量,增强生产数据集成化,提高生产全程的控制化。同时PAT 解决了常规制药批次生产抽样检验方式带来的局限性、偶然性和滞后性等问题。
PAT 与 CM 的关系是现代制药行业的一个重要话题,PAT 的实施为连续制造提供了关键支持,二者结合促进了生产过程的优化和质量保证 [2-3]。这些技术的应用使制药企业能够更有效地应对复杂的市场环境,提升竞争力。因此,深入探讨 PAT 与 CM 的关系及其在制药行业中的实际应用,对于行业未来的发展具有重要的指导意义。通过本综述,旨在为制药行业提供可持续发展的解决方案,助力企业在技术创新与质量管理方面迈出更坚实的步伐。
1、PAT的基本概念与组成部分
过程分析技术 (PAT) 是由 FDA 于2004年提出的一个监管框架[1],旨在鼓励制药行业自愿开发和实施创新的药物开发、生产及质量保证方法。PAT 的核心思想是将质量控制从最终产品检测转移到生产过程的各个环节[4]。通过实时监控和数据分析,确保药品在生产过程中的各项质量指标始终处于可控状态[5-6]。这一理念源于现代制造业的转型趋势,尤其是向数据驱动和智能化发展。传统批量生产模式通常依赖后期检测,尽管在一定程度上能保证产品质量,但难以实时反映生产过程中潜在的问题,导致资源浪费和质量波动。
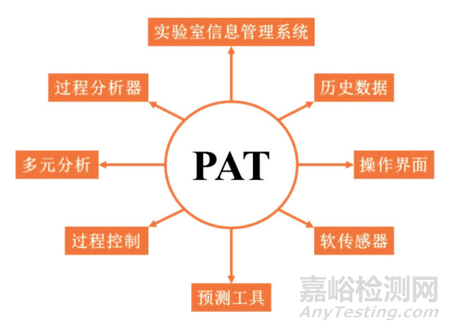
图1 PAT主要组成部分
1.1关键质量属性(CQA)与关键过程参数(CPP)
在 PAT 实施过程中,首先需明确关键质量属性(CQA),即影响药品安全性、有效性和稳定性的物理化学特性。这些属性可能包括药物的浓度、粒径分布、溶解性和均匀性等。通过监测 CQA,企业可以及时识别可能导致产品质量不合格的因素。关键过程参数(CPP)也是 PAT 的重要组成部分,指在生产过程中影响 CQA 的参数,如温度、压力、混合速率和反应时间等。通过对 CPP 的控制和优化,制药企业能够有效管理 CQA,从而确保最终产品的质量和一致性[7]。
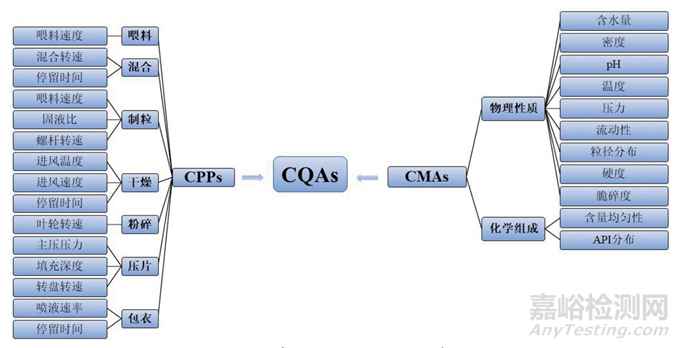
图2 常见影响CQAs的因素
1.2实时监测与数据分析
PAT 的重要特点之一是实时监测[8-9]。在生产过程中,利用先进的分析技术和仪器,如近红外光谱 (NearInfrared Spectroscopy, NIR)、拉曼光谱和质谱,企业可以实时获取关键质量属性和关键过程参数的数据。这种实时监测不仅提高了生产过程的透明度,还能及时识别和纠正偏差。例如,如果在生产过程中监测到某个 CQA 超出预设控制范围,生产团队可以立即调整相应的CPP,以避免产品质量问题的发生。
数据分析在 PAT 中也占据重要地位[10]。随着数据采集和处理技术的进步,企业能够利用统计过程控制 (StatisticalProcess Control, SPC)[11]和机器学习[12]等方法,深入分析实时监测的数据,从而发现潜在的质量问题和优化机会。这种基于数据的决策方式使生产过程更加高效和智能,降低了人力成本和错误率。
1.3反馈机制与过程优化
PAT 提供的动态反馈机制是其另一显著特点。通过实时数据监测和分析,生产团队可以在生产过程中持续优化关键参数。这种反馈机制使企业能够迅速适应生产条件的变化,降低因外部环境或内部因素导致的波动[13]。
例如,在制药生产中,温度和混合速率的变化可能直接影响产品的均匀性和稳定性 [14]。借助 PAT 技术,生产团队可以设定预警阈值,当监测到某个参数接近极限时,系统会自动发出警报,提醒操作人员进行调整。这种及时响应不仅能减少废品率,还能提高整体生产效率和资源利用率。
1.4提高质量保证的意义
PAT 的实施显著提高了制药行业的整体质量保证水平。通过对生产过程的全面监控和实时调整,企业能够将质量控制融入生产流程的各个环节[15]。这种预防性方法大大降低了因质量问题造成的经济损失和资源浪费,增强了消费者对药品安全性和有效性的信任。此外,PAT 还促进了制药行业的合规性。随着全球对药品监管要求的日益严格,企业在生产过程中实施 PAT 能更好地满足监管机构的要求,提升合规性。通过提供透明的生产数据和质量监测报告,企业能够更有效地与监管机构沟通,降低审计风险。
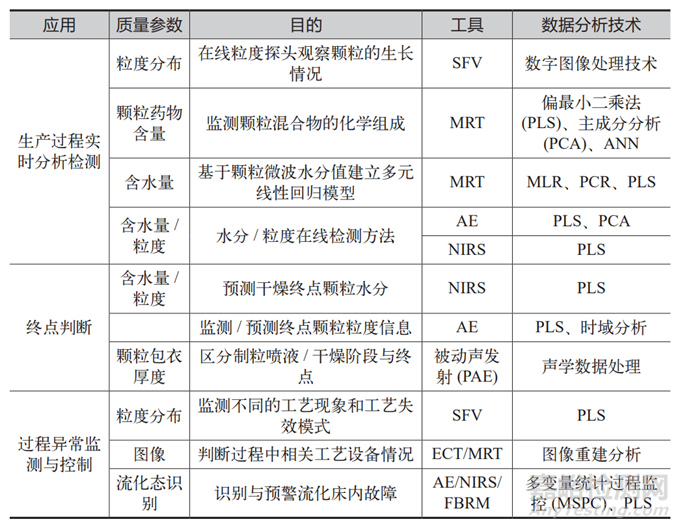
表1 常用PAT工具及分析技术
2、药品连续制造技术简介
2.1连续制造技术概述
在传统的间歇式生产模式中,药品的制造过程通常分为多个阶段,每个阶段完成后都需进行质量检测和分析。尽管这种方法在过去几十年中为制药行业提供了相对稳定的生产方式,其固有的局限性也逐渐显露。首先,间歇式生产面临长生产周期和低资源利用率的问题,每次生产结束后都需进行设备清洗和准备,从而限制了生产效率。其次,质量控制环节的滞后性使企业难以实时识别和纠正生产过程中的问题,通常需要等到产品完成后才能进行质量评估,这增加了废品率和成本。
2.2连续制造技术的优势与挑战
连续制造技术 (CM) 通过将多个生产步骤整合为一个连续的流程,优化了整个生产链。在这一过程中,原料在一个连续的生产系统中经过混合、制粒、干燥、整粒、总混、压片、包衣和包装等多个环节,无需中断。这种连续生产模式使企业能够在相同设备上进行大规模生产,从而实现 24 小时不间断生产,最大化资源利用。CM 的主要优势包括:提高生产效率、优化产品质量、降低成本、更大的灵活性和可扩展性以及能够减少药品短缺[16]等。
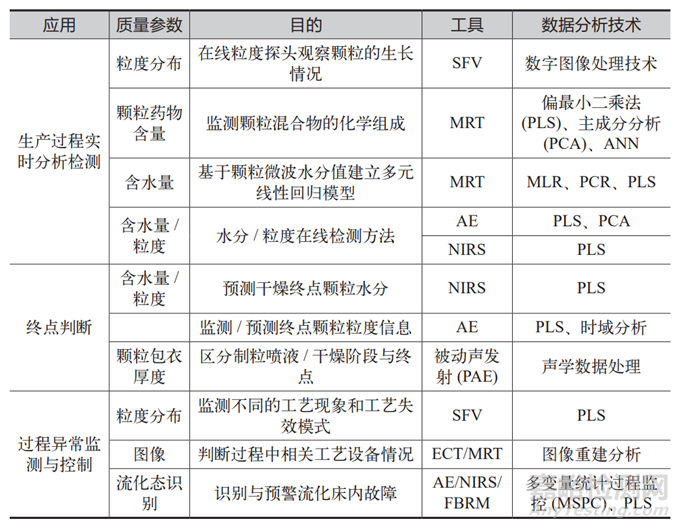
图3 批次生产与连续生产示意图
尽管 CM 在制药行业展现出巨大潜力,其广泛应用仍面临一些挑战。首先,技术的复杂性要求企业具备较高的技术水平和设备投资,这可能使一些中小型企业难以承受。其次,实施连续制造技术需要较大的初始投资,包括购买先进的生产设备和进行员工培训。此外,作为一种新兴技术,CM 的监管框架和标准尚在完善中,制药企业需与监管机构密切合作,以确保生产过程符合法规要求。
3、PAT与CM的相互关系
PAT 与 CM 的结合体现了现代制药行业向智能化、自动化方向发展的趋势。具体而言,PAT 为 CM 提供了实时监测与控制的能力,而 CM 则为 PAT 的数据采集和分析创造了持续的生产环境。
3.1PAT的实时监测与过程优化
PAT 的核心功能在于对生产过程中的 CQA 和 CPP 进行实时监测。通过采用先进的传感器和分析技术,如近红外光谱、拉曼光谱和质谱等,PAT 能够在生产过程中持续获取实时数据。通过分析实时数据,可以识别出影响生产效率和产品质量的关键因素。这种实时监测能力使得生产过程更具灵活性,可以根据 PAT 提供的数据实时调整 CPP,确保生产流程始终处于最佳状态。这种动态调整机制显著降低了生产中的不确定性,并确保产品质量的一致性。
在 CM 环境中,这种实时监测显得尤为重要。由于 CM 的生产过程是一个连续的、动态的体系,任何微小的变化都可能对最终产品的质量产生重大影响。PAT 的应用使生产团队能够对 CPP进行精确控制,避免因参数波动而导致的质量问题[17]。这种动态控制不仅提高了产品的一致性,还显著减少了废品率,进而提升了生产效率。
3.2监管成本与生产成本
制药行业收到严格的监管,PAT 能够帮助制造商满足日益严格的法规要求。通过实施有效的过程控制和检测,药品制造商能够提供详细的生产记录和质量数据,确保其产品符合监管机构的标准。这种透明度和合规性对于维持市场竞争力至关重要。
此外,PAT 与 CM 的联合应用能够显著降低生产成本。实时检测和自动化控制减少了人工干预的需求,提高了生产效率。同时,由于提高了产品质量,减少了因质量问题而产生的返工和废品,从而降低了整体成本。有研究[18]从商业案例角度对 PAT 在 CM 中应用的实际意义进行说明,结果显示了可观的收益率和回报率,并显著节省了成本。这些成功案例表明,PAT 与 CM 的有效结合能够为制药行业带来显著的经济效益和市场竞争力。
3.3智能制造
随着工业 4.0 的到来,智能制造已成为各行各业的追求。在制药行业,PAT 与CM 的结合为实现智能制造提供了基础。通过集成先进的传感器、自动化设备和数据分析工具,制药企业能够实现生产过程的自动化和智能化。
在这一背景下,PAT 作为智能制造的核心组成部分,与 CM 系统无缝对接,实现数据的实时共享与分析。Schmidt[19]等针对数字孪生对过程模型、控制和优化的整体理解进行深入探索,进而实现对生产过程的全面监控与管理。这种整合不仅提高了生产效率,还降低了运营成本,为企业创造了更大的价值。
4、未来发展趋势
展望未来,PAT 与 CM 将在制药行业中扮演越来越重要的角色。随着技术的不断进步,尤其是在在数据分析、人工智能和物联网等领域的应用,PAT 与 CM的协同作用将进一步增强。未来的 PAT 系统将可能具备更强的数据处理能力和智能决策功能,提高生产过程的自动化和智能化水平。此外,PAT 的集成化趋势也愈发明显。未来的制药生产系统将越来越多地采用模块化设计,允许不同的分析技术和控制系统灵活组合,以适应多样化的生产需求和市场变化。这一转型不仅将提升制药行业的整体效率和竞争力,还将推动整个医疗行业向更高水平的发展迈进。
尽管 PAT 和 CM 在制药行业中展现出显著的优势,能够有效提升生产效率和药品质量,但这两项技术在实际应用中仍面临诸多挑战。首先,技术整合的复杂性是制药企业实施该策略时必须克服的主要障碍。PAT 的实施要求企业具备先进的监测和控制设备,并能够实时分析数据。这意味着企业需要在技术设施和信息系统上进行大量投资,这在资源有限的情况下常常导致资金压力。此外,现有生产流程可能需要重组和优化,以适应新技术的引入,从而增加了技术转型的复杂性。其次,人员培训不足也是一大挑战。PAT 和 CM 的有效实施不仅依赖于技术设备的更新,更需要企业员工具备相应的专业技能和知识。监管政策的适应性也是制药企业在推行 PAT 和 CM 时需考虑的关键因素。制药行业受到严格的监管,企业必须遵循现有法规标准,而这些标准往往难以适应快速发展的技术。监管机构需要花费时间理解和评估新技术的应用,而企业则需在遵循法规的同时进行创新。因此,企业在实施新技术时,必须与监管机构保持良好的沟通,以获取必要的支持和指导。
5、结 论
从过程分析技术到药物连续制造的发展,标志着制药行业的技术进步与创新。两者的协同作用不仅提升了生产效率和产品质量,还为数据驱动决策和智能制造的实现提供了基础。随着制药行业的不断发展,PAT 与 CM 的结合将继续推动行业的创新与转型,助力企业在激烈的市场竞争中取得更大的成功。
参考文献
[1] Food and Drug Administration(FDA). Guidance for Industry:PAT - A Framework for InnovativePharmaceutical Development,Manufacturing, and QualityAssurance. U.S. Department ofHealth and Human Services, 2004.
[2] H U A N G Y S , M E D I N A -GONZáLEZ S, STRAITON B,et al. Real-Time Monitoring ofPowder Mass Flowrates for PlantWide Control of a ContinuousD i r e c t C o m p a c t i o n Ta b l e tManufacturing Process [J]. Journalof Pharmaceutical Sciences, 2022,111(1): 69-81.
[3] HETRICK E M, SHI Z Q, HARMSZ D, et al. Sample Mass Estimate forthe Use of Near-Infrared and RamanSpectroscopy to Monitor ContentUniformity in a Tablet Press FeedFrame of a Drug Product ContinuousManufacturing Process [J]. AppliedSpectroscopy, 2021, 75(2): 216-24.
[4] I C H . Q 1 3 C o n t i n u o u sManufacturing of Drug Substancesand Drug Products. InternationalConference on Harmonisationof Technical Requirements forPharmaceuticals for Human Use,2021.
[5] H U A N G Y S , M E D I N A -GONZáLEZ S, STRAITON B,et al. Real-Time Monitoring ofPowder Mass Flowrates for PlantWide Control of a ContinuousD i r e c t C o m p a c t i o n Ta b l e tManufacturing Process [J]. Journalof Pharmaceutical Sciences, 2022,111(1): 69-81.
[6] HETRICK E M, SHI Z Q, HARMSZ D, et al. Sample Mass Estimate forthe Use of Near-Infrared and RamanSpectroscopy to Monitor ContentUniformity in a Tablet Press FeedFrame of a Drug Product ContinuousManufacturing Process [J]. AppliedSpectroscopy, 2021, 75(2): 216-24.
[7] CHEMMALIL L, PRABHAKART, KUANG J N, et al. Online/atline measurement, analysis andcontrol of product titer and criticalproduct quality attributes (CQAs)during process development [J].Biotechnology and Bioengineering,2020, 117(12): 3757-65.
[8] M A D A R á S Z L , K ö T E A ,HAMBALKó B, et al. In-lineparticle size measurement based onimage analysis in a fully continuousgranule manufacturing line forrapid process understanding anddevelopment [J]. InternationalJournal of Pharmaceutics, 2022,612.
[9] WANG X P, TIAN Y, ZHANGS, et al. Real-time droplet sizeanalysis using laser micrometer asa process analytical technology toolfor continuous dripping process [J].Engineering in Life Sciences, 2022,22(9): 594-604.
[10] DüRAUER A, JUNGBAUERA, SCHARL T. Sensors andchemometrics in downstreamprocessing [J]. Biotechnology andBioengineering, 2023.
[11] KIM E J, KIM J H, KIM M S, et al.Process Analytical Technology Toolsfor Monitoring Pharmaceutical UnitOperations: A Control Strategy forContinuous Process Verification [J].Pharmaceutics, 2021, 13(6).
[12] D O M O K O S A , P U S Z TA I É ,MADARáSZ L, et al. Combinationof PAT and mechanistic modelingtools in a fully continuous powderto granule line: Rapid and deepprocess understanding [J]. PowderTechnology, 2021, 388: 70-81.
[13] M O R E N O M , G A N E S H S ,SHAH Y D, et al. Sensor NetworkRobustness Using Model-BasedData Reconciliation for ContinuousTablet Manufacturing [J]. Journalof Pharmaceutical Sciences, 2019,108(8): 2599-612.
[14] ALAM M A, LIU Y A, DOLPHS, et al. Benchtop NIR methoddevelopment for continuousmanufacturing scale to enableefficient PAT application for solidoral dosage form [J]. InternationalJournal of Pharmaceutics, 2021,601.
[15] JUNG E A, PARK Y J, KIM JE. Application of continuousmanufacturing for solid oral dosageforms [J]. Journal of PharmaceuticalInvestigation, 2023, 53(4): 457-74.
[16] ROGGO Y, JELSCH M, HEGER P,et al. Deep learning for continuousmanufacturing of pharmaceuticalsolid dosage form [J]. EuropeanJournal of Pharmaceutics andBiopharmaceutics, 2020, 153: 95-105.
[17] SCHEIDECKER B, BRAAZ R,VINNEMEIER J. Fluid DynamicSampling Site CharacterizationImproves Process CorrelationDuring Continuous Online Sampling[J]. Journal of PharmaceuticalInnovation, 2021, 16(3): 400-7.
[18] FONTALVO-LASCANO M A,ALVARADO-HERNáNDEZ BB, CONDE C, et al. Developmentand Application of a Business CaseModel for a Stream Sampler in thePharmaceutical Industry [J]. Journalof Pharmaceutical Innovation, 2023,18(1): 182-94.
[19] S C H M I D T A , H E L G E R S H ,LOHMANN L J, et al. Processanalytical technology as key-enablerfor digital twins in continuousbiomanufacturing [J]. Journalof Chemical Technology andBiotechnology, 2022, 97(9): 2336-46.
本文作者周国铭、李文龙,天津中医药大学 中药制药工程学院、现代中医药海河实验室,仅供交流学习。

来源:制药工艺与装备


