您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-11-02 08:53
各位小伙伴大家好,琼脂糖凝胶电泳作为分子生物学实验中最为基础而常用的技术,从而在实验室中广泛应用,所以学会琼脂糖凝胶电泳是进入分子生物学实验室的必要技巧之一。
接下来我将着点于,实验原理、实验步骤、注意事项以及疑难解答等几个方面向各位小伙伴们详细阐述。
实验原理
电泳即利用化合物的分子量或带电荷量在稳定电场中所受阻力或者电场力的不同,从而迁移效率不同,来达到分离化合物的目的。而琼脂糖凝胶电泳,简单来说就是以琼脂糖凝胶作为电泳介质来承载化合物进行电泳。琼脂糖是D-和L-半乳糖残基通过α(1→3)和β(1→4)糖苷键交替构成的线状聚合物。琼脂糖链形成螺旋纤维,后者再聚合成半径20~30nm的超螺旋结构。琼脂糖凝胶可以构成一个直径从50nm到略大于200nm的三维筛孔的通道,从而给予化合物分子可以通过的空间以及一定的阻力。
影响DNA的迁移效率的因素
1、通过凝胶的电流与电压
根据欧姆定律,V= IR因为用于电泳的缓冲液通常是微碱性的(pH 7.8~8.0),通过凝胶的DNA分子携带负电荷,并以所施加的电流形成的速率向阳极迁移。
低电压时,线状DNA片段迁移率与所用的电压成正比。但是,电场强度升高时,高分子质量DNA片段的迁移率不成比例增加。所以,当电压增大时,琼脂糖凝胶分离的有效范围反而减小。要获得大于2kb DNA片段的良好分辨率,则所用电压不应高于5~8V/cm。
2、DNA分子的大小
双链DNA分子在凝胶基质迁移的速率与其碱基对数的常用对数成反比。大分子DNA摩擦阻力大,通过凝胶孔径的效率低于小分子DNA,因此迁移速率慢。
3、琼脂糖浓度
琼脂糖凝胶是由氢键和疏水作用聚合在一起的多孔胶体。在电流的作用下,DNA线性分子通过一系列孔径泳动,这些孔径的有效直径取决于凝胶中琼脂糖的浓度。在DNA电泳迁移率的对数和凝胶浓度之间存在线性关系。
4、DNA的构象
超螺旋环状(I型)、切口环状(II型)和线性(I型) DNA在琼脂糖凝胶中迁移速率不同。绝大多数情况下,区分不同构象DNA的最佳方式是在电泳系统中加入未处理的环状DNA样品和在单一限制酶切位点经酶切消化后的同一线状DNA样品。
5、凝胶和电泳缓冲液中的染料
染料插入双链DNA造成其负电荷减少,而刚性和长度增加。因此,线状DNA-染料复合物在凝胶中的迁移率约降低15%。
6、琼脂糖种类
常见的琼脂糖主要有两种:标准琼脂糖和低熔点琼脂糖。正在研制的第三种是熔点和凝点介于,上述二者之间的琼脂糖,它兼有两者的特性。每一大类中都有不同种类的琼脂糖用于不同的分离目的。
7、电泳缓冲液
DNA的泳动受电泳缓冲液的组成和离子强度的影响。缺乏离子(如用水替代电泳槽及凝胶中的缓冲液)则电导率降至很低,DNA迁移极慢,或者完全不动。高离子强度时,如错用了10X电泳缓冲液,电导率升高,即使应用适中的电压也会产生大量的热量。最严重时凝胶会熔化,DNA会变性。
实验步骤
1、选择合适的塑料托盘,置于洁净的制胶模具中,并置于水平实验台上。
2、配制足量的电泳缓冲液(1×TAE或0.5×TBE)用以灌满电泳槽和配制凝胶。
▲配胶和灌满电泳槽使用同一批缓冲液很重要。因为即使很小的离子强度或pH差别也会导致凝胶性能异常,严重影响DNA片段的泳动。当检测未知DNA片段的大小时,一定要保证所有样品在同一缓冲液配置的同样凝胶中分析。
3、根据欲分离DNA片段大小,用电泳缓冲液配制适宜浓度琼脂糖溶液:应准确称量琼脂糖干粉加到盛有定好量的电泳缓冲液的三角烧瓶或玻璃瓶中。
▲缓冲液体积应小于烧瓶或玻璃瓶容积的50%。
▲分离不同大小的DNA所需的琼脂糖凝胶浓度如表。一些高分辨率琼脂糖凝胶能分离只有几个碱基对差别的DNA。此外,经修饰的多糖加到琼脂糖中可以增加分辨率。修饰多糖与琼脂糖混合制成的浓度为0.5%~2.0% (m/V)的凝胶不仅分辨率增加,而且更清亮,强度更好。
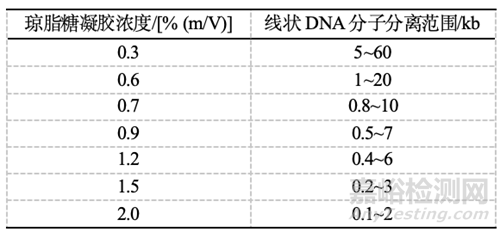
表1 不同含量标准低电内渗琼脂糖凝胶的分离范围
▲警惕:微波炉加热时间过长,琼脂糖溶液会变得过热或剧烈沸腾。
▲仅加热所有琼脂糖颗粒完全溶解需要的最短时间。通常未熔解的琼脂糖呈小透明体或半透明碎片悬浮在溶液中。戴上手套,不时地小心旋转三角烧瓶或玻璃瓶,以保证黏在壁上的未熔化的琼脂糖颗粒进入溶液。
▲熔解较高浓度的琼脂糖需要较长的加热时间。
▲要查看煮沸后是否由于蒸发而溶液体积减少,如有必要用水恢复原体积。
4、待熔化的凝胶稍冷却后加入荧光染料(如:溴化乙锭,终浓度为0.5μg/mL;或按照使用说明加入其他染料)。轻轻地旋转以充分混匀凝胶溶液。
▲警惕: SYBR Gold不应加到熔化的凝胶溶液中。
▲荧光染料也可以直接混入样品,或者待电泳结束后浸泡染色。
5、琼脂糖溶液正在冷却时,选择一个合适的梳子用来制造加样孔。梳齿底部的位置应在托盘底面,上0.5~1.0mm,这样琼脂糖浇灌到托盘时将形成符合要求的加样孔。
▲多数凝胶托盘都有适宜放梳子的侧壁或外侧支架。如果没有或不合适,梳齿可能会太接近托盘底面,在拔出梳子时易穿透加样孔的底部,样品液将从凝胶和加样孔之间泄露。
6、浇灌温热的琼脂糖溶液进入模具。
▲凝胶适宜厚度为3~5mm。需检查在梳齿下或梳齿间应无气泡。熔化的凝胶液中的气泡用擦拭纸的角轻触或使用移液枪即可容易除去。
▲制备低浓度琼脂糖凝胶(<0.5%)时,先倒一个1%浓度琼脂糖的支持胶,它没有加样孔。让支持胶在托盘或玻璃板上室温下硬化,然后再直接在支持胶.上倒低浓度凝胶。此方式制备的凝胶明显减少了在后续如照相或Southern杂交等操作过程中可能造成的低浓度胶断裂。需要保证两个浓度的凝胶用同一批缓冲液配制,且含有相同浓度的染料。低熔点和低于0.5%浓度的琼脂糖凝胶也可以冷却到4°C,并在冷室中电泳以减少断裂的机会。
7、让凝胶溶液完全凝结,室温下需30~45min。加少量电泳缓冲液于凝胶顶部,小心拔出梳子。将凝胶安放到电泳槽内。
8、向电泳槽加入电泳缓冲液,刚好没过凝胶约1mm。
▲没有必要在加样前对琼脂糖凝胶进行预电泳。
9、将DNA样品和对应体积的上样缓冲液混合(常用的DNA上样缓冲液有10×、6×等)。
▲加样孔能加入DNA的最大量取决于样品中DNA片段的大小和数目。若一个5mm宽条带含有500ng以上的DNA时,说明加样孔过载,会导致拖尾、条带两侧卷翘的“微笑效应”和模糊不清等现象。如果DNA长度增加,上述现象变得更为严重。分析单一DNA样品(如λ噬菌体或质粒DNA)时,每个5mm宽加样孔可加100~ 500ng,DNA。如果样品由不同大小的许多DNA片段组成(如哺乳类动物DNA的酶切样品),则每个加样孔加入20~30μg的DNA也不会造成分辨率明显下降。
▲加样DNA的最大体积是由加样孔容积决定的。通用的加样孔(0.5cm×0.5cm×0.15cm)可容纳约40μL样品。切忌将加样孔加得太满,甚至溢出。为避免溢出造成邻孔样品污染,最好配置稍厚些的凝胶能够增加加样孔容积或通过乙醇沉淀浓缩DNA减少加样体积。
10、用一次性吸头、自动移液器、拉长的巴斯德吸管或玻璃毛细管将样品混合液缓慢加至浸没凝胶的加样孔内。DNA分子质量标准品应分别加至样品孔的左侧和右侧的两个孔内。
11、关上电泳槽盖,接好电极插头。DNA应向阳极(红色插头)侧泳动。给予1~8V/cm的电压,其中距离以阳极至阴极之间的测量为准。如电极插头连接正确,阳极和阴极由于电解作用将产生气泡,并且几分钟内溴酚蓝从加样孔迁移进入胶体内。待溴酚蓝和二甲苯蓝FF迁移到适当距离后停止电泳。
▲溴化乙锭的存在使凝胶在电泳的任何阶段都能够置于紫外灯下观察。此时,可以除去托盘,直接放凝胶于透光板上。也可以用一个手提式紫外光源检查凝胶。不管哪种方式,应在检查时短时间关闭电源。
▲电泳期间,溴化乙锭向阴极迁移(与DNA迁移方向相反)。长时间电泳将导致凝胶中溴化乙锭含量显著减少,使小片段DNA检测发生困难。此时,可将凝胶浸入0.5μg/mL溴化乙锭溶液染色30~45min。
12、当DNA样品或染料在凝胶中迁移了足够距离时,关上电源、拔出电极插头并打开电泳槽盖。若凝胶和电泳缓冲液中含有溴化乙锭,用紫外灯观察凝胶和用装有紫外线透射滤光片的CCD相机照相。
13、凝胶电泳结束后可进行切胶回收DNA,也可以进一步进行Southern印迹分析。
疑难解答
1. 使用水代替凝胶缓冲液或电泳缓冲液
琼脂糖凝胶配制和电泳通常使用TAE或TBE缓冲液进行。如果您使用水进行凝胶配制和跑电泳,您的凝胶将在电泳时很快融化。TAE、TBE和水都是透明的溶液;因此,在配制时请检查容器的标签。
2. 使用了错误浓度的琼脂糖
DNA凝胶电泳所需的标准琼脂糖浓度为1.0%。浓度越高,小条带的分辨率越高;反之,琼脂糖浓度越低,大分子量条带的分辨率和分离程度越高。如果使用了错误浓度的琼脂糖凝胶,就很难确定DNA条带的可靠性。当使用低百分比浓度琼脂糖凝胶时要小心;它们往往较软,更容易破损。
3. 颠倒了电泳槽与电源连接线的方向
这是很容易犯的错误,但是如果你不小心颠倒了电泳槽与电源连接线的方向,结果将会非常令人沮丧。因为样本会向相反方向移动,而且由于上样孔与凝胶的末端很近,您会丢失所有的样本。开始您的电泳后确保DNA样本以正确的方向进入凝胶;如果您看到您的条带向错误的方向移动,请颠倒电源线的方向。
4. 什么是适合于您的琼脂糖凝胶电泳的正确缓冲液?
进行DNA琼脂糖凝胶电泳所需的缓冲液类型,主要取决于DNA片段大小和电泳后的应用。进行琼脂糖凝胶电泳最常见的两种缓冲液是Tris-乙酸EDTA缓冲液(TAE)和Tris-硼酸EDTA缓冲液(TBE)。因为两种缓冲液的pH值都接近中性,所以缓冲液中的DNA都带净负电荷并向凝胶装置正极(+)方向移动。
对于小片段DNA (<1000 bp),如果没有计划从凝胶中回收DNA,那么推荐使用1×TBE缓冲液。TBE溶液具有高离子强度和缓冲能力。TAE缓冲液,结合低电场强度(1–2 V/cm),最适于分离大DNA(12–15 kb)。TAE缓冲液与琼脂糖相互作用,相比较TBE缓冲液中的琼脂糖凝胶,会产生更低的电渗透,更大的表面孔经,和更低的电场强度,可降低大DNA的smear现象。
5. 为了获得最好的分辨率您需要的DNA上样量是多少?
DNA样本量可以是各种各样的,关键是您正在分离的DNA条带的DNA含量。最小可能被检测的DNA的量依赖于所使用的染色方法(例如,使用SYBR Safe DNA凝胶染色可以检测出 3 ng的DNA。一个清晰且界限分明的条带中DNA最大量为100 ng。
6. 凝胶配制如何影响条带分辨率?
推荐的琼脂糖凝胶厚度为3-4 mm;厚度超过5mm的凝胶会产生模糊的条带和更高的染色背景。与此类似,覆盖在电泳装置中凝胶上的电泳缓冲液厚度为3-5mm。缓冲液太多会降低DNA迁移率并造成条带变形。
梳齿的厚度也很重要,它会显著影响分辨率。薄梳(1 mm)会给出界限清晰的条带,而厚梳会产生厚条带,导致分辨率降低。梳齿应充分清洗以去掉可能的残留物,否则可能会在泳道内产生波浪线。此外,在去除梳齿前要先加入缓冲液,以减少琼脂糖孔附近的撕裂。
7. 凝胶类型影响条带分辨率吗?
根据DNA的应用和大小,琼脂糖类型会影响DNA分辨率。凝胶强度,凝胶融解温度,和电渗透是选择合适琼脂糖时的重要因素。
8. 您如何选择琼脂糖凝胶电泳运行环境?
推荐的凝胶电泳装置内的电压是4–10 V/cm(正极和负极之间的距离,不是凝胶长度)。如果电压太低,迁移率会降低,而且条带会因扩散而变宽。如果电压太高,条带分辨率会降低,这主要是由于凝胶过热引起的。
9. 若DNA条带呈微笑状、波浪形怎么处理?
一般考虑胶质不均导致的,可以适当提高灌胶温度,选用小分子核酸染料,不在跑胶时进行染色、换在电泳结束后进行泡染(将凝胶浸入0.5μg/mL溴化乙锭溶液染色30~45min)。

来源:实验老司机


