您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-12-05 09:04
SDS-PAGE电泳是蛋白质分离纯化中最常用的技术之一,但实验过程中,我们常常会遇到各种各样的问题。下面总结了一些常见的SDS-PAGE电泳问题以及相应的解决方法,希望对你有帮助!
在了解相关问题之前,我们首先要搞清楚SDS-PAGE电泳是怎么工作的?
想象一下,我们有一堆不同大小的豆子,想把它们按照大小排队。而SDS-PAGE电泳就是蛋白质的“筛子”,它能把不同大小的蛋白质按照“身高”(分子量)排成一队。
SDS
SDS是一种特殊的化学试剂,它可以包裹住蛋白质,让所有的蛋白质都带上负电荷。这样,在电场的作用下,所有的蛋白质都能够向正极移动。
凝胶
凝胶就像一个布满小孔的海绵,不同的孔大小不一,作用类似于蛋白质的“跑道” 。蛋白质在电场的作用下,就像参加比赛一样,从凝胶的一端往另一端跑。大的蛋白质跑得慢,小的蛋白质跑得快。最后,它们就会按照大小排成一个梯度。
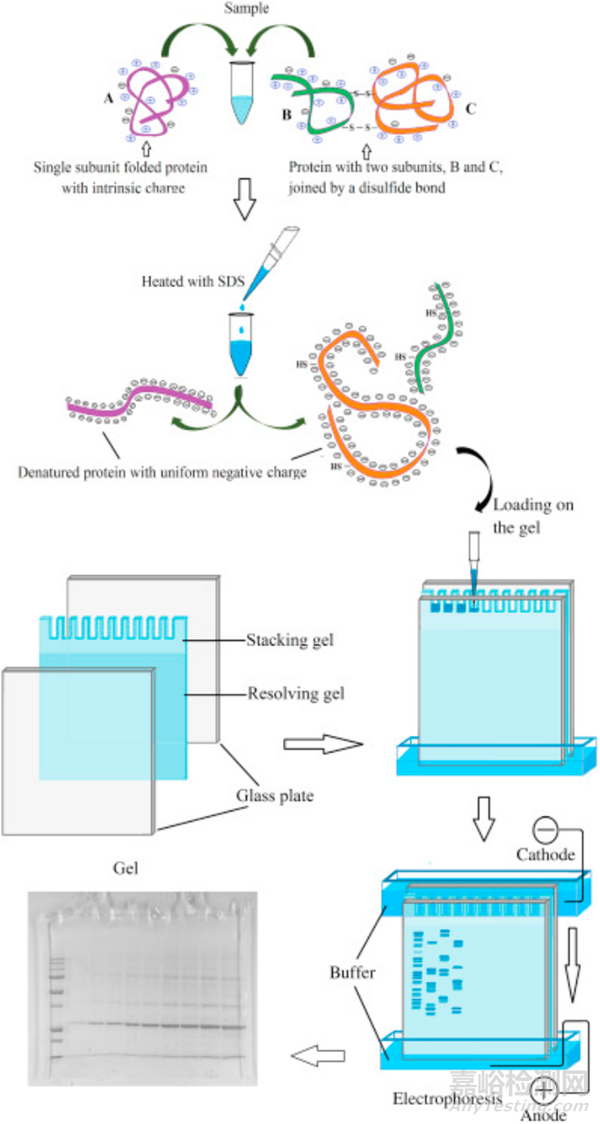
(图片来源:https://gyansanchay.csjmu.ac.in/wp-content/uploads/2022/10/SDS-PAGE.pdf)
常见问题及解答
1、分离胶浓度的选择
在SDS-PAGE电泳中,分离胶浓度是一个至关重要的参数,直接影响着蛋白质的分离效果。浓度越高,孔径越小,越适合分离小分子蛋白质;浓度越低,孔径越大,越适合分离大分子蛋白质。以下是我们总结的一个常见凝胶溶液浓度与蛋白质分子量范围的对应关系表:(仅供参考)
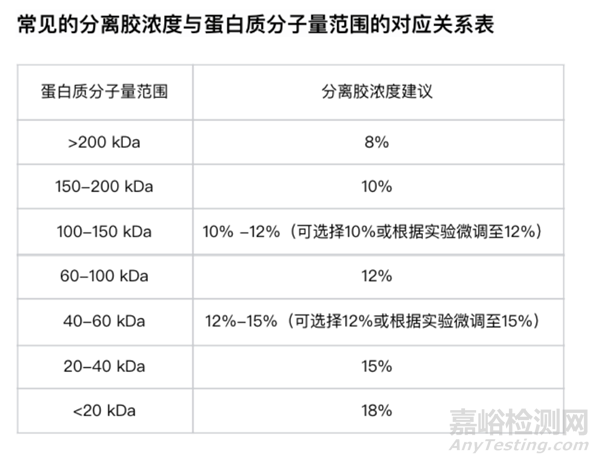
2、凝胶凝结的太慢或不凝固
SDS-PAGE凝胶的凝固时间一般在30分钟~1小时之间。如果凝固速度过慢,很可能是因为引发聚合反应的两种试剂——TEMED和APS出了问题。TEMED和APS的用量不足或者失效都会导致凝胶凝固缓慢。
其中,APS(过硫酸铵)非常不稳定,容易分解失效,所以每次使用前都需要现配。而TEMED也比较敏感,容易被氧化变黄,失去活性。
解决方法:
检查并调整引发剂用量,确保TEMED和APS用量准确,并按比例混合。
保证APS现配现用,避免长时间暴露在空气中。
TEMED要注意避光保存,并置于4℃冰箱中。
3、条带拖尾和弥散
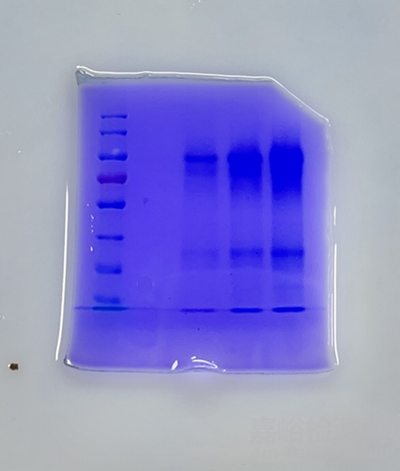
可能的原因:
样品降解:蛋白质在制备过程中发生降解,导致分子量变小,条带弥散。
样品过载:上样量过多,导致条带重叠,分辨率降低。
样品缓冲液配制错误:缓冲液的pH值或离子强度不合适,影响蛋白质的迁移。
样品溶解不充分:蛋白质没有完全溶解,导致部分蛋白质没有进入凝胶。
解决方案:
延长变性时间:确保蛋白质充分变性,一般在95-100℃加热5~10分钟。
减少上样量:逐步减少上样量,直到条带清晰为止。
更换缓冲液:如果缓冲液使用时间过长,需要更换新鲜的缓冲液。
4、“微笑”型条带(条带两边翘起,中间凹下)
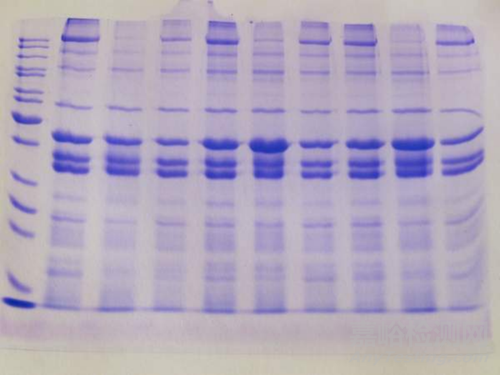
这种现象通常可能是由于以下几个原因造成,需要逐一排查。
凝胶凝固不均匀
在较厚的凝胶中,凝胶的中间部分凝固的不均匀。建议待凝胶充分凝固后再进行后续实验。
电流过大
电流过大可能导致凝胶局部过热,从而引起条带弯曲。可以适当降低电泳电压,减少电流,或使用恒流电源,确保电流稳定。
电泳时间过长
电泳时间过长也可能导致凝胶过热,引起条带弯曲。可以适当缩短电泳时间,并观察溴酚蓝指示剂的位置,当其到达凝胶底部时停止电泳。
玻璃板未夹紧
检查玻璃板之间的密封性,确保没有漏液现象。
上样不均匀
样品在上样时分布不均,也可能导致条带弯曲。建议使用微量移液器缓慢、均匀地将样品加入样品孔中。
5、“皱眉”型条带(条带两边向下,中间鼓起)

出现这种现象通常可能是由于以下几个原因造成:
样品不均一或上样量过多:
样品中含有不溶性颗粒或高浓度盐,导致样品在孔中沉淀,影响电泳迁移。上样量过大导致样品孔中的蛋白质浓度过高,中间部分的蛋白质迁移受到阻碍。建议充分溶解样品,去除不溶性物质,控制上样量,避免过载。
电泳条件不稳定:
电压波动、电流不稳定等因素都会影响蛋白质的迁移。
玻璃板:
玻璃板上有残留的杂质,影响了样品的迁移。也有可能是两块玻璃板之间的底部间隙气泡没有排尽,阻碍电场均匀分布,影响样品迁移。

来源:实验老司机


