您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-12-09 11:37
10月30日,欧盟发布<医疗器械供应中断的义务Q&A>。在该Q&A问题11和问题12中介绍了“制造商信息表”一内容:
11. 如何根据Article 10a 向主管当局提供信息?
为通知有关主管当局,制造商、其授权代表或代表制造商行事的任何其他行为者应提供 “制造商信息表 ”中规定的信息。这些信息随后应提交给制造商或其授权代表所在成员国的主管当局。
应注意的是,成员国可在相关主管当局的网站上提供更多信息,说明如何提交表格中的信息。
12. 根据 Article 10a向主管当局提交通知时,“制造商信息表 ”中应包括哪些信息?
制造商向其或其授权代表所在成员国的主管当局提交通知时,应在 “制造商信息表 ”中包括所有规定的信息(即未标明为自愿提供的信息)。
此外,制造商可通过发送更新表格,自愿向主管当局通报所提交表格的任何相关变更,同时注明 “补充信息 ”或 “后续信息”,在 MIF 第 1 部分 “信息类型 ”分节中反映为自愿。在使用任一选项时,提交者应说明表格的哪些部分被修改,如第 2 部分 “X ”小节。在标注为 “自愿 ”的部分,制造商可提供与中断或中止有关的补充信息,这些信息将有助于主管当局对情况进行评估。
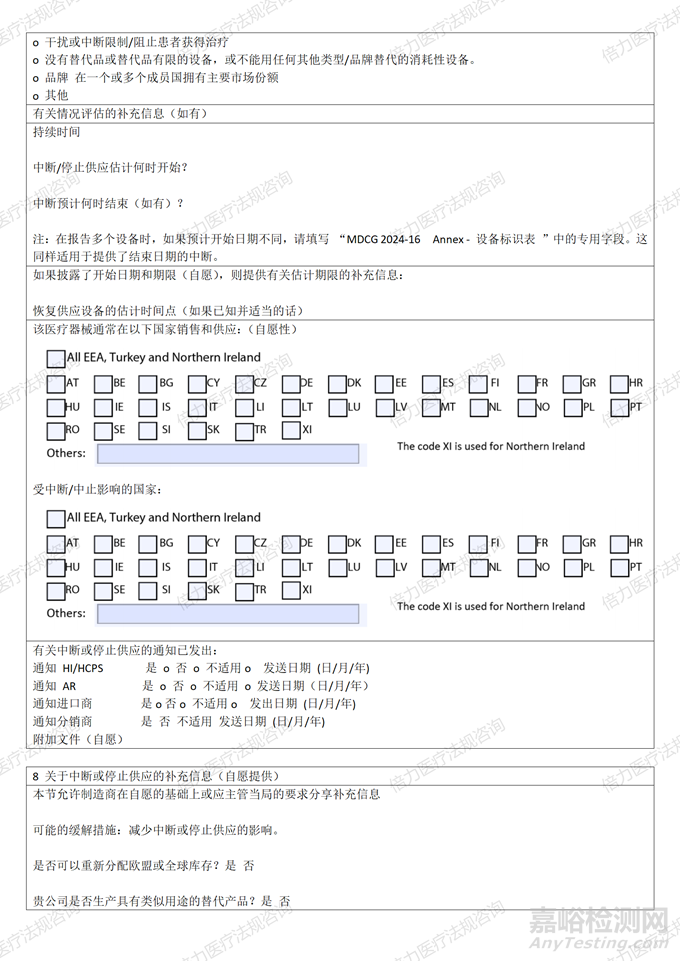
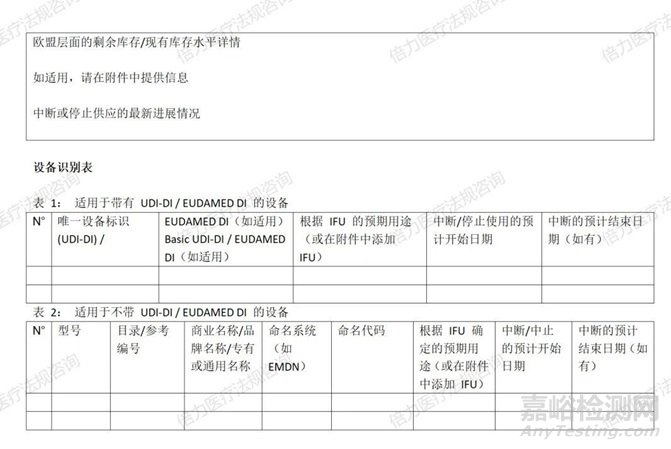
当地时间12月6日,欧盟MDCG小组就发布了<MDCG 2024 - 16 关于中断或停止供应某些医疗器械和某些体外诊断医疗器械的制造商信息表(根据修订MDR 和IVDR的(EU)2024/1860 Article 10a)>。
MDCG 2024-16表单内容



来源:北京倍力医疗技术服务有


