您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-12 19:17
一、基本概况
1、自然环境
加拿大位于北美洲北半部,东临大西洋,西濒太平洋,西北部邻美国阿拉斯加州,南接美国本土,北靠北冰洋至北极圈。海岸线超过24万公里。加拿大国土面积为998.5万平方公里,仅次于俄罗斯,居世界第二位,其中陆地面积909.4万平方公里,淡水覆盖面积89.1万平方公里。
2、人口和行政区划
1、人口分布
据加拿大统计局2023年7月27日实时数据,加拿大总人口约为4018.7万。其中,人口超过百万的省份有7个,分别是:安大略(Ontario)1562.70万人;魁北克(Quebec)888.31万;不列颠哥伦比亚(British Columbia)548.27万人;阿尔伯塔(Alberta)476.82万人;曼尼托巴(Manitoba)145.22万人;萨斯喀彻温(Saskatchewan)122.83万人;新斯科舍省(Nova Scotia)105.94万人。
2、行政区划
加拿大分10个省和3个地区,首都渥太华(Ottawa)地处安大略省,是全国的政治中心。
10个省分别为:阿尔伯塔省、不列颠哥伦比亚省、曼尼托巴省、新不伦瑞克省、纽芬兰—拉布拉多省、新斯科舍省、安大略省、爱德华王子岛省、魁北克省和萨斯喀彻温省。
3个地区是:西北地区、育空地区和努纳武特地区。
3、2024年出口概况
2024年1- 6月,中国向加拿大出口医疗器械约28亿人民币,同比增长约22.06%;2024年1-6月,加拿大新增注册医疗器械产品总计586款,其中112款为中国企业获批。
二、认证体系
1、加拿大医疗器械监管机构和法规要求
加拿大卫生部(Health Canada,HC)负责加拿大的医疗器械产品注册。加拿大医疗器械注册需要遵循 Food and Drugs Act和Medical Devices Regulations (SOR/98-282)的要求。下图为加拿大整体的法律/法规框架:
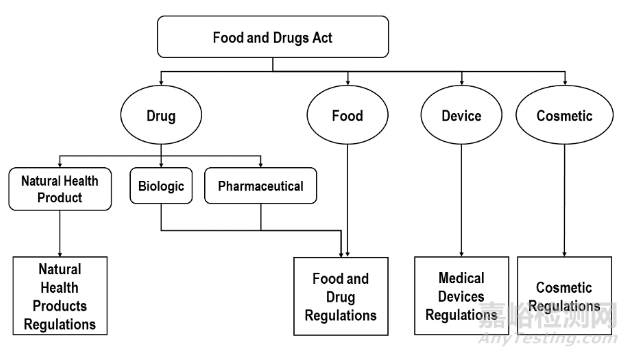
产品进入加拿大市场前,基于不同产品的风险分类或企业不同角色的活动类型,需要申请MDL (Medical Device Licence)证书或MDEL(Medical Device Establishment Licence)证书。
2、医疗器械定义
● 定义来源与范围
Food and Drugs Act section 2定义了器械“Device”,其中包含了兽用器械。在此基础上,Medical Devices Regulations section 1定义了医疗器械 “Medical device”,剔除了兽用器械。因此,加拿大医疗器械是指用于人的医疗器械,囊括了体外诊断器械(IVDD)和非体外诊断器械(non-IVDD)。
● “Medical device”
医疗器械是指Food and Drugs Act定义的器械,但不包括任何用于动物的器械。
● “Device”
器械是指制造、销售或代表用于以下目的的仪器、装置、专用工具或其他类似物品,或体外试剂,包括其中任何一种的组件、零件或附件:
(a)诊断、治疗、减轻或预防人类或动物的疾病、障碍或异常身体状态,或其任何症状,
(b)恢复、改进或纠正人类或动物的身体结构或任何部分的功能,
(c)诊断人类或动物的妊娠,
(d)在人类或动物怀孕期间或在其后代出生时或出生后,照顾人或动物,包括其后代,
(e)防止人类或动物受孕;
不包括仅通过药理学、免疫学或代谢手段或仅通过化学手段在人体或动物体内或体表进行(a)至(e)段所述任何动作的仪器、装置、专用工具或物品,或其任何组件、零件或附件。
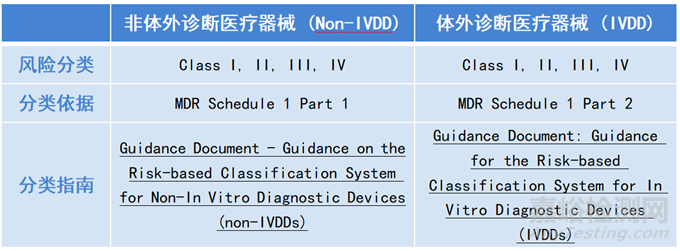
3、产品分类
基于风险,加拿大医疗器械分为4类 (Class I, II, III, IV), 其中Class I风险最低,Class IV风险最高。
三、注册流程
1、MDL证书申请
1、MDL适用对象
进入加拿大市场前,Class II, III, IV医疗器械的制造商必须申请MDL证书。
2、官方审核周期
Class II产品(新申请):15个自然日
Class III产品(新申请):75个自然日
Class IV产品(新申请):90个自然日
3、申请费用
加拿大财年:上一年4月1日~下一年3月31日
费用变化:费用会随通货膨胀上涨变化,每年4月1日起新费用生效。
收费标准:根据不同风险类别,收取不同申请费。具体见下图:
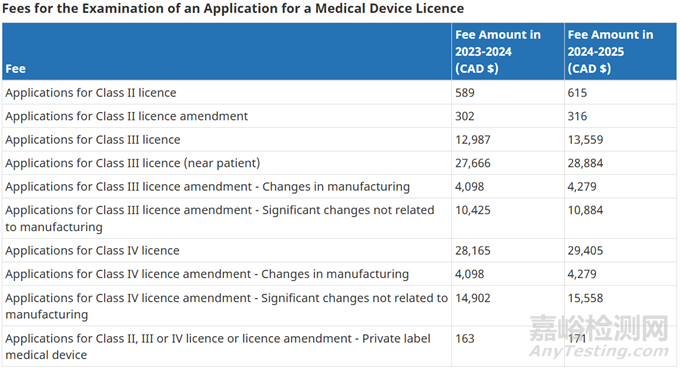
费用减免政策:申请小企业资质,可享受50%的费用减免(适用于所有MDL申请),或全部费用的免除(适用于单个产品线首次递交的申请)。申请资质和条件参考:Small business mitigation for drugs and medical devices:Small business fee reduction measures
费用支付节点:邮件收到HC发来的invoice, 30天内完成支付。
费用支付方式:中国企业常用信用卡和银行电汇进行支付,更多方式参考:How to Pay Health Canada Fees
4、申请资料
法规要求:MDR section 32
标签/说明书语言:卖给普通公众的器械,要求双语英语和法语;其他情况,一种语言英语或法语。
提交资料:MDL申请表、费用表、MDSAP证书、标签/说明书、产品(class III, IV)安全有效性证据等。
● MDL申请表 & 费用表:Medical device application and report forms
● Class III, IV non-IVD器械安全有效性证据:Guidance on supporting evidence to be provided for new and amended licence applications for Class III and Class IV medical devices, not including In Vitro Diagnostic Devices (IVDDs)
● Class III, IV IVD器械安全和性能证据:暂未有相关证据指南。
注意:虽然class II申请不要求提供安全有效性证据,但也要确保产品满足了相关标准。
资料汇总形式:Health Canada adapted assembly and technical guide for IMDRF table of contents submissions
递交方式:电子邮件
5、MDL申请流程

确定MDL证书申请类型(Guidance For the Interpretation of Sections 28 to 31: Licence Application Type)
6、年度续证
目的:确认器械是否将继续在加拿大市场销售,且MDL证书仍旧有效。
官方通知(含要求资料):每年8月初,HC给MDL持有者的监管联络人发送annual licence renewal package,按照指示递交资料、支付费用即可。
递交时间:11月1日前
费用:统一价,不分产品风险类别;每年浮动变化。当前费用见下图:
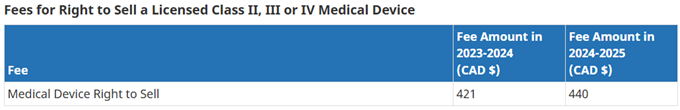
支付时间:收到Invoice后,30天内完成付款。
7、MDL数据库
Medical Devices Active Licence Listing (MDALL)
2、MDEL证书申请
1、MDEL适用对象-基于活动类型
● 不通过有MDEL证书的进口商或经销商销售器械的class I器械制造商(如果通过有MDEL证书的进口商或经销商销售class I器械,制造商无需持有MDEL证书)
● 所有器械的进口商和经销商
注:MDEL证书豁免情况,可参考指南:Guidance on Medical Device Establishment Licensing (GUI-0016)
2、官方审核周期
从收到完成申请资料计时,120个自然日。
3、申请费用
收费标准:每年会变化,当前费用见下表:

费用减免政策:申请小企业资质,可享受25%的费用减免。
费用支付节点:邮件收到HC发来的invoice, 30天内完成支付。
费用支付方式:中国企业常用信用卡和银行电汇进行支付,更多方式参考:How to Pay Your Establishment Licence Fees
4、申请资料
MDEL申请表:Medical device establishment licence application form (FRM-0292)
相关程序文件:申请中或获得MDEL证书后,HC均有可能要求检查申请表中声明的程序文件,如没有,会被认为是虚假声明,HC直接拒绝申请或吊销MDEL证书。因此,申请人务必确保企业有申请表中要求的书面程序文件,可随时供官方检查。
5、申请流程

整体流程见下图:

6、年度续证
目的:确保活动持续符合监管要求 & 保持最新信息(即便没有任何变更,也需要每年提交申请,并依据invoice支付费用)
官方通知(含要求资料):每年12月,HC给MDEL持有企业的联络人发送Annual license review (ALR)申请信息,按照指示递交资料、支付费用即可。
递交时间:4月1日前
费用 & 支付:证书年审费用同MDEL申请费用一样, 支付时间和方式也一样。
7、MDEL数据库
Medical Devices Establishment Licence (MDEL) Listing
四、UDI要求
现状与趋势:加拿大MDR法规暂无UDI相关规定,且当前也没有自己的UDI系统,但是2021-06-28 ~2021-09-30对外进行了意见咨询,计划根据IMDFR发布的UDI指南和美国FDA UDI系统,设计开发自己的UDI系统,或者更新Medical Devices Active Licence Listing(MDALL)数据库的设计,以展示获得MDL证书器械的UDI。
更多细节,参考HC UDI提议:Proposal to introduce a Unique Device Identification (UDI) system for medical devices in Canada
五、质量体系要求
标准依据 & 证书:ISO 13485,MDSAP证书
适用对象:class II 器械制造商(制造)、class III & IV器械制造商 (制造和设计)。
注:虽不要求class I器械制造商 & 所有风险类别的进口商和经销商有MDSAP证书,但必须有相应的上市后程序文件。
注:虽不要求class I器械制造商 & 所有风险类别的进口商和经销商有MDSAP证书,但必须有相应的上市后程序文件。
MDSAP证书由具备授权资质的第三方审核机构颁发。

来源:广东医疗器械学会


