您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-10 08:28
|
NDA 代号 |
216951 (JESDUVROQ (daprodustat) |
|
申请人 |
GlaxoSmithKline Intellectual Property (No. 2) Limited England |
|
剂型 |
片剂 |
|
规格 |
1 mg, 2 mg, 4mg, 6 mg, 和 8 mg |
|
途径 |
口服 |
|
每日最大剂量 |
24mg |
|
原研/OTC |
原研 |
|
拟定适应症 |
治疗成人透析患者慢性肾病引起的贫血,而不是透析患者。 |
|
产品描述 |
Daprodustat片,1毫克,灰色包衣层,圆形(直径约7毫米),双凸片,一面压印有“GS KF”。 Daprodustat片,2毫克,黄色包衣层,圆形(直径约7毫米),双凸片,一面压印“GS V7”。 Daprodustat片,4毫克,白色包衣层,圆形(直径约7毫米),双凸片,一面压印有“GS 13”。 Daprodustat片,6毫克,粉红色薄膜涂层,圆形(直径约9毫米),双凸片,一面压印有“GS IM”。 Daprodustat片,8毫克,是橙色薄膜涂层,圆形(直径约9毫米),双凸片,一面压印有“GS 5E”。 |
|
联合包装产品信息 |
无 |
|
包装信息 |
无 |
|
储存条件 |
在20°C至30°C(68°F至86°F)下储存。 |
溶出方法和接受标准
Daprodustat片是一种速释片剂(1mg、2mg、4mg、6mg、8mg),每天给药一次。表4概述了溶解方法的开发。企业提到,在早期临床研究中,溶出方法A和B之前已经为0.5mg至100mg片剂规格范围的开发。在缩小片剂规格后,开发了一种溶出方法C,作为在III期临床试验中测试Daprodustat片剂的优化溶出方法。后来方法D被开发为一种更好的区分力方法。然而方法D仅用于研发目的,拟定的商业方法,方法E,是对方法D的进一步优化。
企业提供了DOE研究,以证明上述每个参数的含义。评估了溶出方法C和方法E的等效性。企业递交了溶出方法开发报告,包括检测关键生物利用度属性变化的区分能力,以及该方法的验证,包括溶出方法参数小幅变化时方法的稳健性。
企业提出了基于ICHQ6A的速释制剂单点溶出接受标准。Daprodustat片的拟定溶出度验收标准为45分钟时Q= XX。企业表示溶出度验收标准是根据临床批次观察的溶出曲线、以及溶出度对生物药剂学的影响、体内/体外生物等效性数据、相对生物利用度研究和f2统计分析设定。
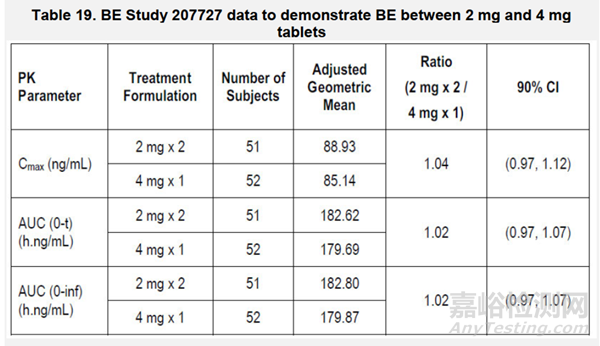
根据对健康志愿者临床1期首次人体研究(PHX11427),企业得出结论,在300mg剂量下,没有观察到饱和药代动力学(Cmax,AUCO-t),表明溶出不是吸收速率的限速步骤。基于BE研究207727(2mg vs 4mg)和体外溶出数据,所有规格都证明了互相间的等效性。4mg规格的溶出数据被认为可以代表所有规格进行溶受限度制定。
相对生物利用度研究213022 A部分包括两批4mg规格Daprodustat片,由批量工艺制得,这些片的生产是为了提供与连续工艺生产的4mg规格Daprodustat片的对照批次进行对比,得到溶出相关的差异化曲线。

BE研究结果表明,所有三个批次都是等效的。因此,45min的时间点不会拒绝掉生物相关批次。值得注意的是,30min的时间点会拒绝生物相关批次。
FDA:根据ICHQ6A,“单点测试通常被认为适合于速释制剂。”因此,拟定的单点溶出是可以接受的。2022年3月29日,我们要求从关键临床和注册批次中获取的批次溶出数据。申请人于2022年4月14日(SN 012)提供了答复。申请人表示,3.2.R.3章节中中提供了94个批次(BE批次、注册和稳定批次)的单个溶出数据。SN 012提供了关键临床研究中使用的另外30个批次和32个注册/稳定批次(15个批次是批量生产和16个批次是连续过程生产)的溶出数据(见表8和表9)。根据信息,评估了30个关键临床批次和BE批次的溶出数据,了解与临床相关的溶出情况。45分钟内Q=XX标准在BE批次中也是支持的。因此企业拟定的45min的Q点标准是可以接受的。
企业表示,拥有适当的控制策略可以确保在连续生产期间的产品质量。拟定的商业化溶出方法足够敏感,可以检测生产运行期间产品质量的任何变化。通过使用差异化溶出的样品开发的安全空间,为产品质量提供了保证。工艺验证批次的溶出数据都表现出相似性(f2)。因此,考虑到全部信息(例如,安全空间、设计空间和所有规格工艺验证批次的实时数据),拟定的溶出方法接受标准得到了有力的支持。
为了确认通过连续工艺和批量工艺生产Daprodustat片剂的生物等效性,进行了一项关键的BE研究#213002 B。该研究中,对于对照样品(通过连续工艺生产的片剂)和测试产品(通过批量生产)的每个片剂规格,采用了连续生产三个生产规模批次。针对三个批次,对每个工艺生产的每个规格制剂,使用拟定商业化溶出方法(方法E)得到的快速溶出曲线批次进行BE研究。此外,提供了每种片剂规格使用方法E的对比溶出曲线。
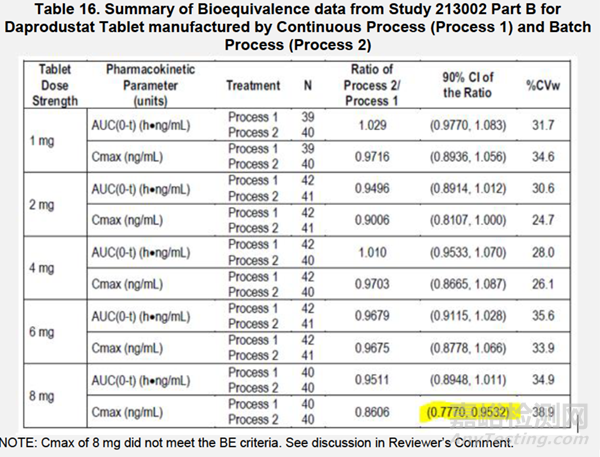
根据对比的溶出数据,1mg、2mg和6mg的溶了在XX分钟大于XX,无需计算f2,即可确定相似性。4mg和8mg规格的相似度值(f2)分别为71和66(f2>50)。因此,所有规格都证明了溶解曲线的相似性。
此外,企业对Daprodustat片剂(1mg、2mg、4mg、6mg、8mg)拟定的商业化片剂规格进行了规格间的等效性评估。测试的片剂是使用连续工艺生产的,但结果也适用于批量生产的片剂。体内BE研究#207727,显示2mg和4mg规格之间的等效性。

处方根据处方成分,临床I期和I期样品相似。处方没有显著变化。因此,在临床1期阶段和2期阶段样品之间不需要桥接。临床2期样品和3期样品之间的区别在于原料药的差异。申请人对用使用早期工艺生产的片剂(临床1期和临床2期)生产的片剂和使用后期原料药(临床3期)生产的片剂进行了BE研究。这两种产品都符合BE标准,具有生物等效性。因此,临床Il期和Ill期产品是可比的,它们的溶出对比数据,也没有显著变化。
为了桥接批量批次生产与连续工艺生产批次,企业对所有批次进行了BE研究213002 B部分。该研究符合BE标准,此外,QC介质中的比较溶出曲线,显示所有规格溶解曲线的相似性(f2>50或>XX分钟>XX溶出)。吸收的Cmax(Cmax)并不符合BE标准。企业阐述了基于临床经验,Daprodustat片的临床有效性是被总暴露量(AUC)决定的,而非吸收(Cmax)决定。而且,8mg规格的变异性较高。FDA表示,“daprodustat片的疗效是由AUC驱动的。尽管企业使用剂量反应模型而不是暴露反应模型来指导剂量选择,因为带有PK暴露(AUC)的模型没有提供比单独剂量更好的反应预测因素。”
申请人使用体内BE研究(#207727)以及多介质的溶出研究提供了片剂规格间的相似性。根据体内和体外数据,不同片剂规格是等效的。
【解读】
企业在早期有开发两个溶出方法,在III期有开发另外一个方法,最终商业化的方法在III期的方法基础上进一步优化。企业使用了DOE的方式,充分证明拟商业化方法与III期方法之间的可桥接性。
企业根据药动学人体研究和制剂的溶出曲线数据,表明药物的溶出不是药物吸收的限速步骤,因此使用了4mg规格的溶出曲线数据用于制剂Q点。
所有规格的溶出数据对比,可以支持两种拟商业化生产方式的可行性,批量生产和连续化生产的制剂体外数据等效的,同时企业也使用了BE体内数据,说明两种商业化生产方式得到的制剂是一致等效的。
企业在整个临床研究期间和最后商业化时,开发了多种溶出方法,证明了它们之间的等效性。企业在研发期间没有变更原料药和制剂的厂地,也就不需要这类桥接。
企来提交了5个规格的上市,使用了多次溶出方法数据对比,多次BE数据的对比,来说明不同规格,不同生产方式得到的制剂都是等效的,很重要的一个原因是daprodustat片的疗效是由AUC驱动,溶出仅用于放行质量控制,与体内吸收相关性不大。

来源:蒲公英Ouryao


