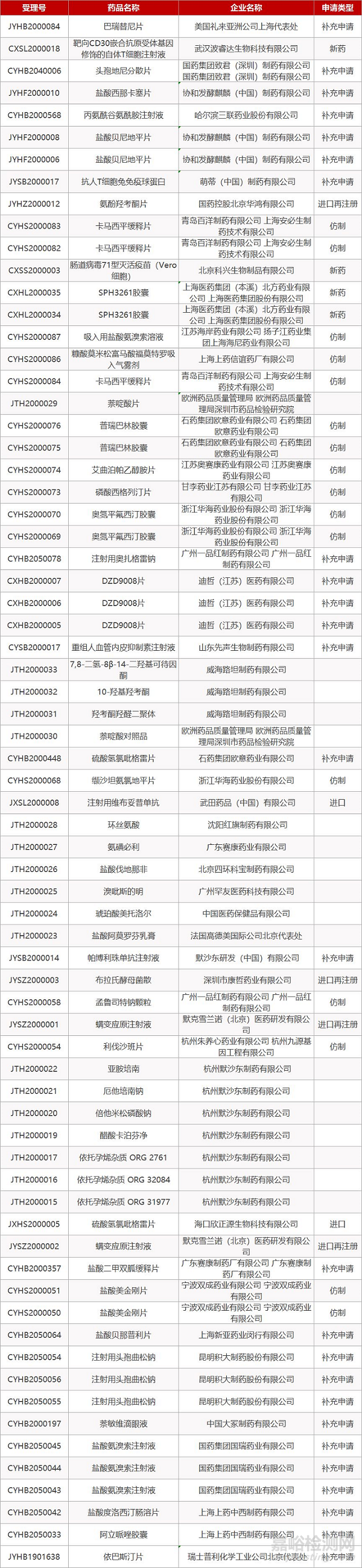
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
誉衡生物PD-1申报上市。1月30日,誉衡药业发布公告称其参股公司誉衡生物委托药明生物研发的抗PD-1全人创新抗体药GLS-010注射液已提交新药上市申请,用于治疗复发或难治性经典霍奇金淋巴瘤,由独立第三方CRO影像服务公司提供的客观缓解率接近92%。目前基于一项超过300例的临床试验数据显示GLS-010在各肿瘤患者应用的耐受性及安全性良好。
1.吉利德瑞德西韦将在武汉开展临床试验。2月2日上午,CDE官网显示,新型冠状病毒肺炎的潜在药物瑞德西韦(remdesivir)临床试验申请已获受理。该试验为临床Ⅲ期试验,面向新型冠状病毒感染的轻、中度患者,计划入组病人270名。试验将由中日友好医院牵头开展,牵头PI为曹彬教授。试验计划于2020年2月3日开始,2020年4月27日结束。此前有外媒报道,一位美国新冠肺炎感染者在使用静脉注射瑞德西韦治疗后病情好转。瑞德西韦最早是吉利德针对埃博拉病毒研发的一款药物,已在国外完成了Ⅰ、Ⅱ期临床试验。
2.百济神州计划将PARP抑制剂临床试验从Ⅲ期转变为Ⅱ期。1月30日,百济神州发布公告,计划将其PARP抑制剂pamiparib对比安慰剂作为用于无法手术的局部晚期或转移性胃癌患者在铂一线化疗响应后维持治疗的临床试验从Ⅲ期转变为Ⅱ期。百济神州声称该变化的原因与药物的安全性或疗效无关。自2018年7月起,该临床试验已在全球范围内招募患者约120名,招募速度慢于预期。百济神州发表声明后,其当天股价跌幅超7%。
1.创新血液肿瘤组合疗法获FDA突破性疗法认定。Aprea Therapeutics公司宣布,FDA授予其在研疗法APR-246突破性疗法认定,与azacitidine联用,治疗携带TP53基因突变的骨髓增生异常综合征(MDS)患者。p53肿瘤抑制蛋白的突变被认为可直接导致MDS患者疾病进展和总体预后不良,而APR-246是一款小分子药物,可重新激活已经突变失活的p53蛋白。值得一提的是,FDA此前还授予了APR-246治疗MDS的孤儿药资格(ODD)和快速通道资格(FTD)。
2.武田卡博替尼在日本申请上市。Exelixis宣布其合作伙伴武田已在日本递交Cabometyx(cabozantinib,卡博替尼)上市申请,治疗在接受了先前治疗后,疾病依然出现进展的不可切除性肝细胞癌。卡博替尼是Exelixis开发的口服小分子酪氨酸激酶抑制剂,它可以抑制c-Met,VEGFR2,以及AXL和RET激酶的活性。武田将负责该药物的临床开发和推广。
3.替格瑞洛治疗急性卒中达到Ⅲ期试验终点。阿斯利康的口服腺苷二磷酸(ADP)受体可逆性结合拮抗剂替格瑞洛(ticagrelor,商品名Brilinta),在治疗急性卒中患者的Ⅲ期试验THALES中达到主要研究终点,其与阿司匹林单药治疗相比,替格瑞洛联合阿司匹林显著降低再发脑卒中和死亡复合事件发生率。THALES 研究是目前样本量最大的关于缺血性脑卒中双抗治疗的随机对照试验,研究于2018年开展,在全球28个国家和450个中心进行,随机患者超过11,000例。THALES研究中国区域PI为首都医科大学附属天坛医院王拥军教授,中国有60个中心参与,入组患者数超过1,400例。
4.反义寡核苷酸新药达到Ⅱ期终点。Akcea 公司宣布,其反义寡核苷酸药物AKCEA-ANGPTL3-LRx,在治疗患有高甘油三酯血症,2型糖尿病,和非酒精性脂肪性肝炎(NAFLD)患者的Ⅱ期试验中,达到显著降低甘油三酯水平的主要终点,及多个次要终点。 该项Ⅱ期研究共有105名患者参与,试验数据将与辉瑞分享,并由辉瑞规划该药物的未来潜在发展道路。
5.礼来RET抑制剂获优先审评。礼来(Lilly)宣布,其RET抑制剂Selpercatinib已获FDA授予优先审评资格,治疗携带RET融合阳性非小细胞肺癌(NSCLC)晚期患者,RET突变髓样甲状腺癌(MTC)和RET融合阳性甲状腺癌患者。预计FDA将在今年第三季度对该项新药申请(NDA)做出回复。Selpercatinib是礼来收购Loxo Oncology公司时获得的高度特异性,强力口服RET抑制剂。它不但可抑制天然RET信号通路,也可抑制可能出现的获得性抗性。
6.再生元与赛诺菲皮炎疗法获优先审批。再生元与赛诺菲联合宣布,其抗炎症疗法Dupixent已获FDA授予的优先审评资格,治疗6-11岁患有中度至重度特应性皮炎的儿童患者。FDA的预计回复日期为今年5月26日。 Dupixent可抑制IL-4与IL-13的信号通道,而这正是驱动特应性皮炎病理的关键因子。Dupixent若能获批,将成为美国适龄儿童首款特应性皮炎生物制品疗法。
1.广东药监局拟将肺炎一号方纳入应急审评。1月31日,广东药监局拟将广州市第八人民医院拟申报的医疗机构制剂肺炎一号方纳入应急审批。肺炎1号方在广州市第八人民医院的新型冠状病毒感染肺炎治疗中显示:治疗新型冠状病毒感染轻症肺炎确诊病人50例,经1周临床观察,全部患者体温恢复正常,50%患者咳嗽症状消失,52.4%咽痛症状消失,69.6%乏力症状消失,总体症状明显好转,无一例患者转重症。该制剂批准后,将委托广东一方药业进行配制,可短期内满足省内医疗机构调剂使用。
2.国务院要求各地设立24小时应对疫情心理援助热线。国务院应对新型冠状病毒感染的肺炎疫情联防联控机制2月2日发布通知,要求各地要在原有心理援助热线的基础上设立应对疫情心理援助热线,每条热线至少开通2个坐席,结合本地公众需求提供24小时免费心理服务。地方政府应当对热线主办机构给予适当经费补助。
【智飞生物】公司全资子公司安徽智飞龙科马生物制药有限公司与中国科学院微生物研究所签署协议,共同合作开发2019-nCoV重组蛋白亚单位疫苗。
【金城医药】四川赛卓药业股份有限公司拟向金城医药控股孙公司广东赛法洛药业有限公司业转让一类新药利他唑酮干混悬剂临床试验批件(批件号为:【2018L02182】)及全套申报资料和其他技术资料,以及相关技术成果。
【普利制药】公司地氯雷他定片获得德国联邦药物和医疗器械管理局(BfArM)所签发的上市许可。
暂无