您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-02-25 10:07
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
梯瓦氘代药物两项研究失败。梯瓦制药氘代药物AUSTEDO(deutetrabenazine,氘代丁苯那嗪)在治疗中重度抽动秽语综合征的两项临床(Ⅱ/Ⅲ期ARTISTS 1和临床Ⅲ期ARTISTS 2)试验中均未能达到主要终点。在两项研究中,经YGTSS-TTS评估,与安慰剂组相比,氘代丁苯那嗪治疗组在耶鲁综合抽动严重程度量表-总抽动得分(YGTSS-TTS)的变化上均不具统计学意义的显著改善。最常报告的不良事件是头痛、嗜睡和疲劳。在入组患者中,未发现新的安全性信号。
1.国家药监局应急审批通过3个新型冠状病毒检测产品。2月22日,国家药监局应急审批通过3家企业3个新型冠状病毒检测产品,扩大了新型冠状病毒的检测方法和手段。获批的3家企业3个产品分别是万孚生物的新型冠状病毒(2019-nCoV)抗体检测试剂盒(胶体金法)、英诺特的2019-新型冠状病毒IgM/IgG联合检测试剂盒(胶体金法),以及博奥生物的新型冠状病毒(2019-nCoV)恒温扩增芯片核酸检测试剂。
2.拜耳前列腺癌新药darolutamide拟纳入优先审评。拜耳(Bayer)公司在中国申报的ODM-201(darolutamide)获国家药监局拟纳入优先审评公示名单。darolutamide是拜耳/Orion公司联合开发的一种非甾体雄激素受体抑制剂,已于2019年7月获FDA批准用于治疗非转移性去势抵抗性前列腺癌患者,商品名Nubeqa。在一项名为ARAMIS的临床研究中,darolutamide联合雄激素剥夺疗法(ADT)较安慰剂联合ADT能显著延长患者无转移生存时间(40.4个月vs18.4个月)。
3.诺华CAR-T疗法CTL019在华获批第二项临床申请。诺华CAR-T细胞疗法CTL019的一项临床试验申请获国家药监局默示许可,适应症为:暴露于基于慢病毒的CAR-T细胞治疗的患者的长期随访。此前,CTL019在中国已获批开展治疗复发/难治性侵袭性B-细胞非霍奇金淋巴瘤的临床研究。CTL019是全球首款CAR-T疗法,于2017年8月获FDA批准用于治疗复发/难治性儿童、青少年B-细胞急性淋巴细胞白血病,商品名为Kymriah。根据诺华最新的财报,Kymriah在2019年销售额为2.78亿美元。
4.恒瑞医药SHR5126获批临床试验。恒瑞医药口服A2AR拮抗剂SHR5126片的临床申请获国家药监局批准,拟用于实体廇患者的治疗,具体适应证待临床试验确定。目前,国内外在研的口服小分子A2AR拮抗剂共有3个,分别为Corvus开发的CPI-444,诺华开发的PBF-509和阿斯利康开发的AZD4635。其中,除PBF-509已进入II期临床试验阶段外,其他均处于I/Ib期临床试验阶段。国内外尚无同类产品上市销售,亦无销售数据。
5.阿达木单抗登记新冠肺炎临床。中国临床实验注册中心显示,阿达木单抗(商品名:格乐立)登记一项治疗新冠病毒肺炎(COVID-19)重型和危重型患者的临床研究。该研究旨在比较在标准化治疗基础上,观察加/不加阿达木单抗治疗重型以及危重型COVID-19肺炎的临床疗效和安全性。申请单位为上海长征医院,所用药物格乐立为百奥泰公司捐赠。格乐立是国内首个获批上市的阿达木单抗生物类似药,由百奥泰生物自主开发。
6.广州凯普医药联合核酸检测试剂盒开发成功。凯普生物宣布,其子公司广州凯普医药已研发出“新冠病毒COVID-19、甲型流感(FluA)及乙型流感(FluB)联合核酸检测试剂盒(荧光PCR法)”。该试剂盒仅对新型冠状病毒COVID-19、甲型流感病毒及乙型流感病毒RNA的体外定性检测和鉴别,用于临床和筛查人群的快速分流,不用于治疗。目前该产品尚未取得医疗器械注册证书,仅用于科研使用。
1.全球首个预防偏头痛的静脉注射药物获FDA批准上市。丹麦灵北(Lundbeck)CGRP靶向抗体药物Vyepti(eptinezumab-jjmr)获FDA批准用于成人偏头痛的预防性治疗。Vyepti是FDA批准的首个用于预防偏头痛的静脉注射(IV)药物。在两个Ⅲ期临床(PROMISE-1和PROMISE-2)中,Vyepti均到达主要终点:1-3个月的平均每月偏头痛天数(MMD)减少。最早在输注后第1天就观察到两种剂量的Vyepti均比安慰剂有治疗益处,并且在前7天的大部分时间里,发生偏头痛的Vyepti患者的百分比均低于安慰剂。
2.Baudax非阿片类止疼药获FDA批准上市。Baudax Bio公司开发的长效非甾体抗炎药(NSAID)Anjeso(meloxicam)注射液获FDA批准,可单独使用或与其它NSAID联用,治疗中重度疼痛。两项Ⅲ期临床结果显示,在接受拇囊炎切除术患者的临床治疗中,与安慰剂组相比,接受Anjeso治疗后48小时内疼痛强度差的时间加权总和(SPID48)指数降低了31%。在接受腹壁成形术患者的临床治疗中,与安慰剂组相比,接受Anjeso治疗后24小时内疼痛强度差的时间加权总和(SPID24)也达到统计学意义上的显著改善。
3.罗氏Rozlytrek在日本获批治疗NSCLC。罗氏(Roche)控股的日本药企中外制药(Chugai)宣布,日本厚生劳动省(MHLW)已批准靶向抗癌药Rozlytrek(entrectinib)一个新的适应症,用于治疗ROS1融合阳性、不可切除性、晚期或转移性非小细胞肺癌(NSCLC)成人患者。Rozlytrek是一种抗癌剂/酪氨酸激酶抑制剂,在日本已获批用于治疗神经营养性酪氨酸受体激酶(NTRK)融合阳性晚期或复发性实体瘤成人及儿童患者。一项全球性II期STARTRK-2研究显示,Rozlytrek在ROS1阳性转移性NSCLC患者中的总缓解率为78%,完全缓解率为5.9%。在40例病情缓解的患者中,有55%缓解持续时间≥12个月。
4.NoNO公司PSD-95抑制剂III期临床结果出炉。NoNO公司在研PSD-95抑制剂Nerinetide关键性III期临床ESCAPE-NA1获积极结果。在经历过血管内血栓切除术急性缺血性卒中患者中,与安慰剂相比,无需事先服用阿替普酶(标准护理)而接受静脉输注Nerinetide,患者在功能独立性(59.4% vs 49.8%)、死亡率降低(-40%)和脑梗死面积减少(-22%)方面具有重要改善。所有入组患者(接受和未接受阿替普酶后使用Nerinetide)在90天后达到身体功能独立性患者比例的主要终点分析没有统计学意义。Nerinetide的安全性与安慰剂相当。结果同时在国际卒中会议和《柳叶刀》上发表。
5.Mustang自体CAR-T疗法早期结果积极。Mustang Bio靶向CD20的自体CAR T细胞疗法在治疗复发/难治性B细胞非霍奇金淋巴瘤(NHL)的I/II期临床试验(NCT03277729)中早期结果积极。该研究拟招募大约30例患者,评估MB-106的最大耐受剂量。次要终点包括安全性和毒性,初步的抗肿瘤活性由总缓解率和完全缓解率、无进展生存期、总生存期来衡量。目前结果显示,接受最低起始剂量MB-106治疗的第1例患者已达到了完全缓解。
1.新冠肺炎病人再次感染可能性极低。近日,成都市一出院患者再次出现核酸检测阳性的消息在朋友圈广为传播。据悉,该患者已被重新收治。对此,相关专家认为新冠肺炎患者痊愈后再次感染的可能性极低,因为一旦痊愈,人体内就有了针对这种病毒的免疫力。该患者再次出现阳性,最大的可能就是检测标本的差异。目前,第六版诊疗方案已把”上呼吸道鼻咽拭子检测”改为”下呼吸道肺泡灌洗液的标本检测”作为出院标准,将”连续两次检测为阴性才满足出院标准”增加至3次。
2.医疗物资企业复工复产率或超100%。2月24日上午,国务院新闻办公室举行新闻发布会,介绍统筹新冠肺炎疫情防控和经济社会发展工作。根据目前的监测,上海、山东、湖南等地重点外资企业复工率已经超过80%;中小企业总体开工逐步回升,开工率接近30%;五大类的医疗物资企业复工复产率、开工率有的达到或超过了100%,采取了边保供边复产边扩产的举措,医疗物资的产能不断释放,湖北一线医护人员所需要的重点医疗物资得到了基本保障。
3.全国多地下调新冠肺炎疫情应急响应等级。近日,依据国家有关法律法规规定和各地新冠肺炎疫情防控形势,多地对新冠肺炎疫情的应急响应等级进行了调整。其中,广东一级响应调整为二级;甘肃一级响应调整为省级三级;辽宁一级响应调整为省级三级;贵州一级响应调整为省级三级;山西一级应急响应调整为二级;云南一级应急响应调整为省级三级。
【复星医药】公司合营公司复星凯特的药物益基利仑赛注射液(拟定)获药品上市注册审评受理(受理号:CXSS2000006国),该药用于成人复发难治性大B细胞淋巴瘤治疗。
【迈克生物】2019年度实现营业收入32.23亿元(+20.02%);归母净利润5.28亿元(+18.66%)。
【美诺华】公司与KRKA拟同比例向科尔康美诺华增资合计3亿元,其中公司增资1.2亿元,KRKA增资1.8亿元。增资后,科尔康美诺华注册资本将由2.3亿元变更为5.3亿元,双方股东持股比例保持不变。
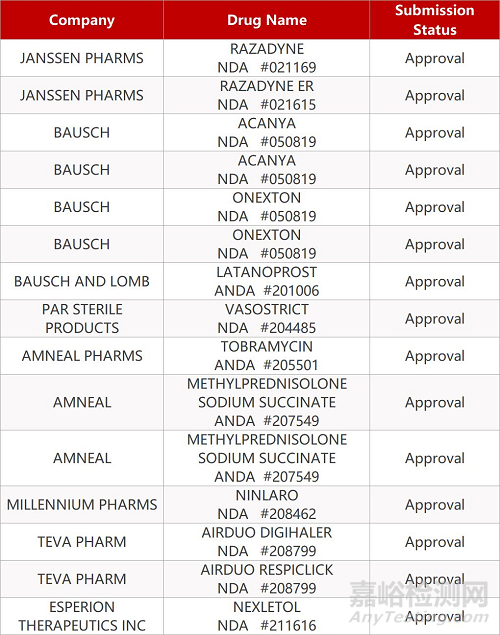
1. CDE最新受理情况(2月24日)

- The End -

来源:药研发


