您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-13 09:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
赛诺菲IL-6抑制剂拟开展COVID-19临床研究。再生元宣布与赛诺菲联合开展评估其类风湿性关节炎药物Kevzara治疗新冠肺炎的临床研究。Kevzara是由这两家公司联合开发的一款IL-6抑制剂,于2017年获FDA批准用于治疗类风湿性关节炎患者。据悉,IL-6抑制剂会阻断某种蛋白质,从而阻断人体启动免疫反应,有望帮助新冠肺炎患者的免疫系统停止攻击健康细胞,在治疗COVID-19引起的肺部并发症方面具潜在的临床疗效。
1.尖峰药业盐酸帕罗西汀片通过一致性评价。尖峰药业仿制药盐酸帕罗西汀片收到国家药监局核发的《药品补充申请批件》,该药通过一致性评价。盐酸帕罗西汀片主要用于治疗抑郁症、强迫症、伴有或不伴有广场恐惧症的惊恐障碍、社交恐惧症/社交焦虑症;亦可作为维持疗法用于继续预防抑郁症、惊恐障碍和强迫症的复发。目前,盐酸帕罗西汀片已纳入国家医保目录和国家基本药物目录。2018年,盐酸帕罗西汀片国内医院销售约为3.78亿元。
2.豪森第三代EGFR-TKI创新药即将获批。3月11日,豪森药业宣布,其第三代EGFR-TKI创新药甲磺酸阿美替尼片(商品名:阿美乐)日前已经完成技术审评,处于“在审批”状态,有望近期在中国获批上市。据悉,甲磺酸阿美替尼片是中国首款自主研发的第三代EGFR-TKI,能够不可逆地、高选择性抑制EGFR敏感突变和T790M耐药突变,拟用于治疗局部晚期或转移性非小细胞肺癌(NSCLC)患者。
3.国产流感病毒裂解疫苗(四价)即将获批。3月11日,长春生物制品研究所的流感病毒裂解疫苗(四价)上市申请已进入“审批完毕-待制证”状态,有望于近日获批上市。据悉,国内流感疫苗折算批签发量TOP10品牌,华兰生物的四价流感病毒裂解疫苗以23.90%的市场份额排在首位,金迪克生物的四价流感病毒裂解疫苗排在第九位。此外,上海生物制品研究所、北京科兴生物、武汉生物制品研究所的四价流感病毒裂解疫苗,以及民海生物的冻干b型流感嗜血杆菌结合疫苗等新药上市申请均在审评审批中。
4.复星医药旗下Tenapanor片获批临床。复星医药控股子公司复星医药产业的合作品种Tenapanor片(10mg/20mg/30mg)获国家药监局批准,即将开展用于终末期肾脏病-血液透析(ESRD-HD)患者高磷血症治疗的III期临床试验。Tenapanor片是Ardelyx公司开发的化学药品,主要用于治疗便秘性肠易激综合症和终末期肾病透析患者高磷血症。截至日前,Ardelyx的Tenapanor片用于终末期肾病透析患者高磷血症尚处于美国III期临床试验阶段。
5.复宏汉霖HLX10临床试验获新进展。3月11日,复宏汉霖于中国境内就重组抗PD-1人源化单克隆抗体注射液(HLX10)联合化疗(白蛋白紫杉醇)用于治疗经一线化疗失败的晚期宫颈癌启动II期临床研究。HLX10是复星集团自主研发的创新型治疗用生物制品,拟用于实体瘤治疗,目前也正进一步探索慢性乙型肝炎治疗的可能性。截至目前,HLX10单药或联合用于实体瘤治疗研究涉及的适应症包括食管鳞癌、鳞状非小细胞肺癌和晚期实体瘤等。
6.极目生物与Clearside达成合作协议。极目生物与致力于研发并提供眼底疾病疗法的制药公司Clearside Biomedical就Clearside 的核心产品XIPERE™(曲安奈德脉络膜上腔注射混悬液)达成独家许可协议。XIPERE™目前正被开发用于葡萄膜炎性黄斑水肿的针对性治疗。根据协议,极目生物将会在大中华区和韩国进行XIPERE™用于其他眼科适应症的开发和商业化。Clearside将获得总计不高于3550万美元的开发和销售里程碑款项,以及XIPERE™年度净销售额的10%到12%的销售分成。
1.BMS双重免疫疗法组合获FDA批准。百时美施贵宝PD-1抑制剂Opdivo(nivolumab)获FDA批准,与CTLA-4抑制剂Yervoy(ipilimumab)联用,治疗既往接受过索拉非尼治疗的肝细胞癌(HCC)患者。该组合疗法也是FDA批准的针对该患者群的首个双重免疫疗法。在一项Ⅰ/Ⅱ期临床CheckMate-040中,经过至少28个月的随访,该组合疗法在既往接受索拉非尼治疗的HCC患者中的缓解率达33%(16/49;95% CI:20-48);完全缓解率达8%(4/49)。缓解持续时间为4.6至30.5月。BMS的Opdivo和Yervoy此前已获FDA批准治疗转移性黑色素瘤等其它癌症类型。
2.罗氏新一代HPV检测产品获批上市。FDA批准罗氏的下一代细胞学检测CINtec®PLUS作为第一个基于生物标志物的分类检测,用于通过cobas® 4800 HPV检测为人乳头瘤病毒(HPV)阳性的女性原发性宫颈癌筛查。Cobas 4800 HPV检测系统是罗氏目前宫颈癌早期预防和筛查的检测产品,可提供HPV 16型、18型和其他12个高风险亚型的筛查结果。临床通过cobas 4800 HPV DNA检测进行初步筛选,并使用CINtec®PLUS细胞学检测进一步分类,以检测HPV感染女性疾病是否有恶变的情况。罗氏预计将于今年晚些时候在美国全面商业化该产品。
3.礼来CGRP抗体药物Emgality新适应症申请在欧盟遇阻。欧洲药品管理局人用医药产品委员会建议拒绝批准礼来Emgality(galcanezumab)用于治疗成人发作性丛集性头痛(ECH)的新适应症申请。CHMP认为,营销授权申请所递交的一项III期研究数据并没有清楚地显示出Emgality在ECH患者中预防头痛发作的疗效,其益处不大于风险。在美国和欧盟,Emgality已分别于2018年9月、11月获批用于预防性治疗成人偏头痛,Emgality用于治疗ECH的新适应症在美国于2019年6月获批。
4.CytoDyn公司递交新冠肺炎II期临床申请。CytoDyn公司向FDA提交了一份临床申请,拟开展一项II期临床评估leronlimab治疗因新冠病毒感染引起的轻中度呼吸系统疾病的成人患者。leronlimab是一种人源化IgG4单克隆抗体,可靶向阻断趋化因子受体5(CCR5),这是一种细胞受体,在HIV感染、肿瘤转移和其他免疫介导疾病(包括NASH)中发挥多种作用。在美国,FDA已授予leronlimab预防移植物抗宿主病的孤儿药资格。
5.FDA授予新型PI3Kδ/CK-1ε抑制剂umbralisib孤儿药资格。TG Therapeutics公司宣布,FDA授予PI3Kδ/CK-1ε双效抑制剂umbralisib(TGR-1202)治疗滤泡性淋巴瘤(FL)的孤儿药资格。此前,FDA已授予umbralisib治疗所有3种边缘区淋巴瘤(MZL)(淋巴结、淋巴结外、脾脏MZL)的孤儿药资格,以及授予umbralisib治疗既往已接受至少一种抗CD20疗法的复发/难治性MZL成人患者的突破性药物资格。目前,TG公司已向FDA滚动提交umbralisib用于治疗先前已接受治疗的MZL和FL患者的新药申请,预计今年上半年完成滚动提交。
1.钟南山团队:新筛查方式滴血15分钟出结果。钟南山院士团队叶枫课题组在《医学病毒学杂志》在线发表论文,初次描述了IgM-IgG联合抗体检测试剂的研发,以及在新冠病毒感染性疾病临床诊断中的应用。据介绍,该检测试剂滴血可验,约15分钟就能出结果。多中心的临床标本检测评价证实,该检测试剂临床检测的敏感性高达88.66%,检测特异性为90.63%;IgM-IgG联合抗体检测的敏感性远高于IgM或IgG单抗体检测。此外,该检测试剂盒亦可用指尖采血方式进行检测。
2.世界上第二例HIV感染者被治愈。医学杂志《柳叶刀》发表的一项研究显示,1例艾滋病病毒携带者卡斯蒂列霍已经在两年多的时间里没有检测出活病毒,被认定是世界上第2例被治愈的HIV(人体免疫缺陷病毒)感染者。此前只有2008年的“柏林病人”蒂莫西·雷·布朗被成功治愈过艾滋病。研究论文的主要作者古普塔认为在“柏林病人”身上使用的干细胞移植疗法是可复制的。据悉,卡斯蒂列霍只接受了一次干细胞移植,而且过程中没有进行全身放疗。
3.世卫组织宣布新冠肺炎疫情大流行。11日,世卫组织总干事谭德塞在日内瓦举行的例行记者会上宣布,新冠肺炎疫情从特征上可称为大流行。据介绍,过去两周中国以外新冠肺炎确诊病例数增长了13倍,受影响国家和地区数增加了两倍;目前114个国家和地区的确诊病例累计超过11.8万例,死亡病例达到4291例,还有数以千计的人在医院里为生存而战。未来几周内预计确诊病例数、死亡人数、以及受影响国家和地区数量还将进一步攀升。
【康缘药业】麻杏止哮颗粒、苁蓉润通口服液获得药物临床试验通知书,前者用于治疗支气管哮喘慢性持续期(热哮证),后者适应于功能性便秘(阳虚秘)。
【香雪制药】2017年更新后的年度报告:2017年度公司实现营业收入21.87亿元(+17.47%),实现归母净利润0.66亿元(-0.13%),扣非归母净利润-1.52亿元(-1,069.45%)。
【海翔药业】根据公司战略布局与未来规划的需要,公司拟对全资子公司川南药业进行存续分立,分立后川南药业继续存续,同时在浙江省台州市临海市临海头门港新区东海第六大道设立全资子公司奇联环保。
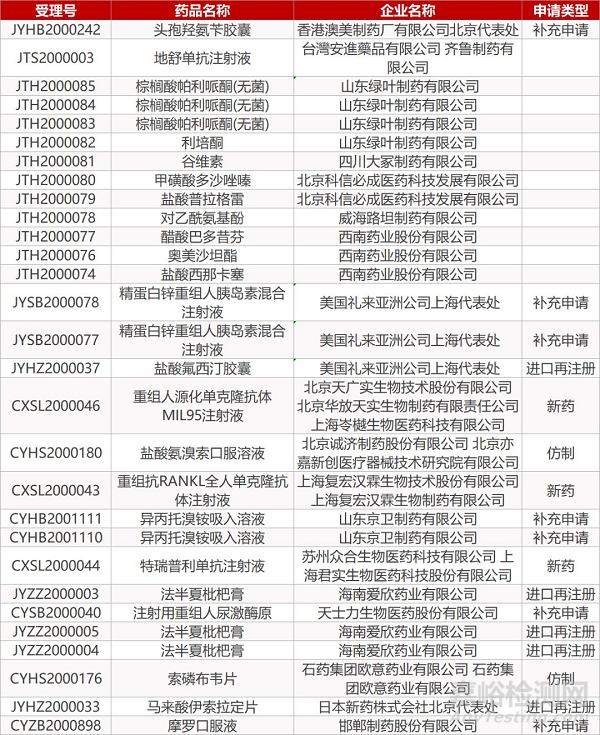
1. CDE最新受理情况(3月12日)
- The End -

来源:药研发


