您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-16 11:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
强生EGFR-MET双抗组合疗法在华获批4项临床。强生EGFR-MET双抗药物amivantamab注射液和三代EGFR-TKI药物lazertinib片的联合疗法获得4项临床试验默示许可,适应症分别为:amivantamab联合lazertinib用于治疗EGFR 19号外显子缺失或L858R激活突变,且在使用第一代或第二代TKI进行一线治疗或在使用第三代TKI(如奥希替尼)进行一线或二线治疗后出现疾病进展的非小细胞肺癌患者(NSCLC);Amivantamab联合lazertinib用于治疗EGFR 19号外显子缺失或L858R激活突变,且经奥希替尼或其他获批的三代EGFR TKI治疗以及含铂双药化疗后疾病进展的NSCLC患者。
国内药讯
1.龙海药业奥氮平片通过一致性评价。龙海药业4类仿制药奥氮平片获国家药监局批准上市并视同通过一致性评价。奥氮平是首个获批用于精神分裂症长期治疗的非典型抗精神病药物,原研厂家为礼来。米内网数据显示,2019年中国公立医疗机构终端奥氮平片剂销售额超过40亿元。其中,豪森药业市场份额超过60%;其次是印度瑞迪博士实验室和礼来,市场份额占比均超过10%。截至目前,该品种已有8家企业13个品规通过一致性评价。
2.爱美津制药罕见病用药拟纳入优先审评。爱美津制药4类仿制药麦格司他胶囊上市申请获CDE纳入拟优先审评公示名单,用于成人及儿童C型尼曼匹克病患者的进行性神经症状的治疗。麦格司他(miglustat)是一种葡糖神经酰胺合成酶抑制剂,原研产品由Actelion公司开发(已被强生收购),已于2015年获批进口中国,商品名为泽维可。除了Actelion公司和爱美津制药,目前尚未有其他公司在中国申报麦格司他的临床试验或上市申请。
3.亚盛医药原创新药APG-11获FDA孤儿药资格。亚盛医药自主研发的原创新药APG-115获FDA授予治疗胃癌的孤儿药资格。APG-115是一款口服小分子MDM2抑制剂,对MDM2具有高度结合亲和力,通过阻断MDM2-p53相互作用从而恢复p53的肿瘤抑制活性。目前已在中国和美国展开多项治疗实体瘤及血液肿瘤的临床研究,并在治疗胃癌的临床前研究中显示了相当的潜力。APG-115也是亚盛医药第3款获得FDA孤儿药资格认定的药品。
4.恒瑞吡咯替尼新适应症获批临床。恒瑞医药抗肿瘤创新药马来酸吡咯替尼获国家药监局批准,即将开展II期临床评估用于既往一线化疗失败的HER2异常的晚期/转移性胆道癌患者的潜力。马来酸吡咯替尼是中国首个原研EGFR/HER2靶向药物,也是中国首个凭借II期临床研究获国家药监局有条件批准上市的创新药,已于2018年8月获批上市。截至目前,该新药已在中国开展了14项临床研究,适应症涵盖乳腺癌、肺癌、胆道癌等多个瘤种,
5.岸迈生物PD-1/LAG-3双抗EMB-02在美获批临床。岸迈生物双免疫检查点抑制剂EMB-02的新药临床申请(IND)获FDA批准。EMB-02是岸迈生物专有的FIT-Ig®(Fabs-In-Tandem免疫球蛋白)技术平台开发的、可同时靶向PD-1和LAG-3的双特异性抗体。在针对PD-1抗体单药治疗耐药的临床前模型中,EMB-02给药组有一半的肿瘤出现完全消退,而PD-1单抗无明显的抗肿瘤作用。EMB-02是该公司第二个自主开发的针对实体瘤的新型双抗候选药物。
国际药讯
1.阿斯利康Fasenra治疗鼻息肉达Ⅲ期临床终点。阿斯利康IL-5抑制剂Fasenra与类固醇联用,在经过标准治疗手段后(皮质类固醇和手术切除息肉)仍患有鼻息肉患者的Ⅲ期临床OSTRO中达到两个主要终点。安慰剂相比,Fasenra治疗组第40周时患者的内镜总鼻息肉评分(NPS)和平均鼻塞分数(NBS)均具有统计学意义的改善,而且其安全性和耐受性与之前研究一致。目前Fasenra已在美国等多个国家获批作为重度嗜酸性哮喘的附加维持治疗药物,并在多个国家获批用于患者自己进行疾病管理的药物。
2.JAK抑制剂/瑞德西韦组合疗法达Ⅲ期临床终点。礼来和Incyte公司开发的类风湿性关节炎新药baricitinib(JAK抑制剂)与瑞德西韦联用,在由美国国家过敏与传染病研究所(NIAID)赞助的用于COVID-19患者的Ⅲ期临床ACTT-2中,达主要终点指标。与瑞德西韦相比,这一组合将患者的中位恢复时间缩短了大约一天。该研究还达到了一个关键性次要终点。详细结果将发表在同行评议的期刊上。
3.礼来5-HT1F受体激动剂REYVOW偏头痛Ⅱ期结果积极。礼来在PAINWeek 2020会议上公布其偏头痛治疗药物REYVOW(拉米地坦)Ⅱ期临床CENTURION的积极结果。与安慰剂相比,偏头痛发作患者接受100mg或200mg REYVOW在治疗2小时的疼痛缓解比例分别高出3.8倍(25.8%vs8.4%;p<0.001)和4.6倍(29.3%vs 8.4%;p<0.001);在24小时达到持续疼痛缓解的比例分别高出3.5倍(13.6%vs4.3%;p<0.001)和4.7倍(17.3%vs4.3%);各治疗组的严重不良事件发生率相似。Reyvow也是FDA批准的首款“地坦”(ditans)类药物。
4.赛诺菲/再生元Dupixent获FDA突破性疗法认定。FDA授予赛诺菲/再生元Dupixent(度普利尤单抗)突破性疗法认定,用于治疗12岁及以上的嗜酸性粒细胞性食管炎(EoE)患者。在一项Ⅲ期临床Part A中,Dupixent达到了两个主要终点以及所有关键的次要终点。Dupixent治疗组第24周的患者DSQ量表疾病症状评分改善21.92分、安慰剂组改善9.60分,两组疾病症状分别减少69%和32%(p=0.0002);Dupixent治疗组有60%的患者嗜酸性粒细胞计数下降至正常范围,安慰剂组为5%。
5.默沙东联手Seattle Genetics开发创新ADC。Seattle Genetics公司和默沙东达成两项战略合作。两家公司将在全球范围内联合开发和推广Seattle Genetics公司靶向LIV-1的抗体偶联药物(ADC)ladiratuzumab vedotin,评估其单药或与Keytruda联用,治疗三阴性乳腺癌、激素受体阳性乳腺癌和其他LIV-1表达实体肿瘤的效果。根据协议,Seattle Genetics将获6亿美元的预付款、10亿美元的股权投资以及高达26亿美元的里程碑付款。在另一项合作中,Seattle Genetics授予默沙东在特定区域商业化小分子酪氨酸激酶抑制剂Tukysa的权益,用于治疗HER2阳性癌症。Seattle Genetics将获得1.25亿美元的前期付款,和可能高达6500万美元的里程碑付款。
6.GRAIL拟IPO募资推进癌症早筛检测。癌症早筛技术公司GRAIL提交了IPO申请,目前未透露具体的拟融资额度。GRAIL开发的液体活检项目会从患者血液中提取无细胞DNA(cfDNA),然后通过对cfDNA甲基化状态的分析发现癌症的存在及其组织来源。此前的研究数据也表明,GRAIL公司的癌症早期检测能够通过血液检测出50多种癌症的所有阶段,而假阳性率不到1%。GRAIL公司还计划明年推出大型测试Galleri,为更多的患者提供早期检测。
医药热点
1.ECMO临床应用有最低门槛。国家卫健委发布《体外膜肺氧合(ECMO)技术临床应用管理规范》,对医疗机构及其医务人员开展ECMO技术提出要求,并要求建立健全ECMO技术临床应用监测和评估制度。《规范》指出,开展ECMO技术的医疗机构,要有重症医学科或重症监护病房,3名以上经过ECMO技术培训并考核通过的专业技术人员,其中至少两名执业医师。还要具有开展心功能衰竭D期心脏功能检测、连续心排量监测等设备设施和能力。
2.湖北:三级中医院全得设康复科。湖北省卫健委等7部门联合印发《关于建立完善老年健康服务体系的实施意见》,明确到2022年,三级中医医院设置康复科的比例达100%,二级及以上综合性医院设立老年医学科的比例达50%;到2022年,省级培育1家~2家老年医院,至少50%的县(市、区)依托二级及以上综合医院设置1家老年医院或1处老年病病区,30%的县(市、区)至少有1家医疗机构(医养结合机构)开展安宁疗护服务。
3.2020年北京流感疫苗接种工作方案公布。北京市卫健委公布2020年北京市流感疫苗接种工作方案,努力推动实现2020年全市流感疫苗接种数较2019年增加20%、中小学生流感疫苗接种率达到50%以上的目标。根据该方案,免费流感疫苗接种人群有3类:具有北京市居民身份证明/社会保障卡,年龄在60周岁以上的老年人;所有在校的各类中小学校学生;各区卫健行政部门认定的重大活动应急保障人员(含新冠肺炎疫情防控一线人员)。
股市资讯
【海思科】创新药HSK16149胶囊Ⅱ/Ⅲ期临床试验获得北京大学第一医院伦理批准,该产品拟开发治疗糖尿病周围神经痛及带状疱疹后神经痛的适应症。
【透景生命】全资子公司透景诊断的抗髓过氧化物酶抗体、抗蛋白酶 3 抗体、抗肾小球基底膜抗体测定试剂盒(流式荧光发光法)取得上海市药品监督管理局颁发的医疗器械注册证;用于体外定量检测人血清中抗髓过氧化物酶(MPO)抗体(IgG)、抗蛋白酶 3(PR3)抗体(IgG)、抗肾小球基底膜(GBM)抗体(IgG)的浓度,作辅助诊断。
【兴齐眼药】公司新药伏立康唑滴眼液于今日获得国家药品监督管理局签发的药物临床试验批准通知书,同意开展真菌性角膜炎的临床试验。该产品通过竞争性抑制真菌羊毛甾醇14α-去甲基化酶,使细胞膜重要组成成分麦角甾醇的生物合成受阻而发挥抗真菌作用。
审评动向
1. CDE最新受理情况(09月15日)
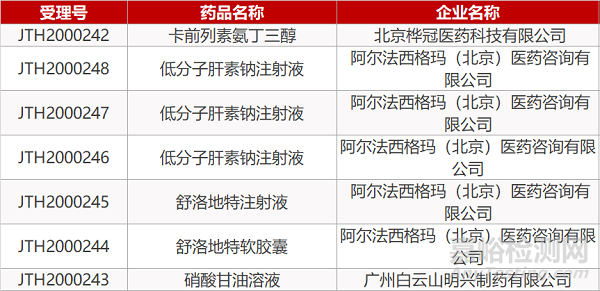
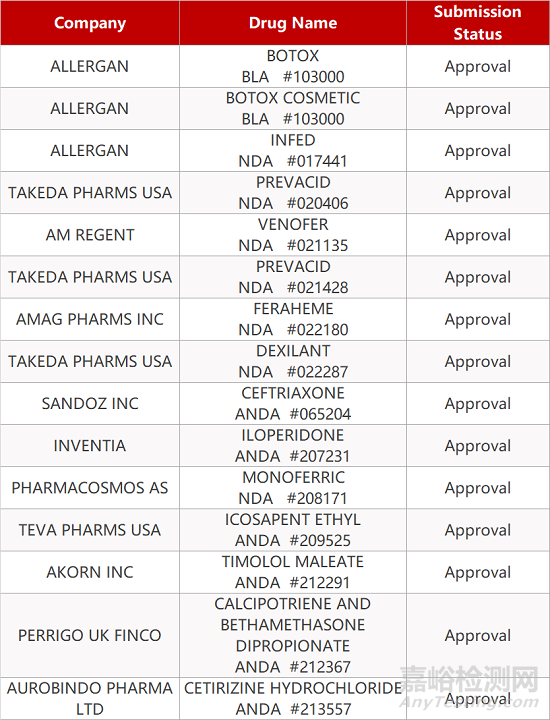
2. FDA最新获批情况(北美09月13日)
- The End -

来源:药研发


