您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-17 09:43
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.恒瑞他克莫司缓释胶囊国内首家申报上市。恒瑞「他克莫司缓释胶囊」的上市申请获CDE受理。他克莫司是一种强效免疫抑制剂,用于预防肝、肾、心脏移植后术后器官排斥反应,治疗肝脏或肾脏移植术后应用其他免疫抑制药物无法控制的移植物排斥反应。原研药由日本藤泽公司(现安斯泰来)开发,其缓释胶囊于2010年获批进口中国。目前,国内该品种的缓控释剂型,仅原研安斯泰来获批上市。恒瑞为国内首家申报「他克莫司缓释胶囊」的企业。
2.荣昌生物纬迪西妥单抗启动Ⅲ期临床。荣昌生物注射用重组人源化抗HER2单抗-MMAE偶联剂(注射用纬迪西妥单抗,disitamab vedotin)登记启动一项Ⅲ期临床,拟入组351例复发/转移后至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部癌)患者,评估注射用纬迪西妥单抗治疗的有效性和安全性。由北京肿瘤医院沈琳教授担任主要研究者。目前,纬迪西妥单抗用于上述适应症的的新药上市申请已被CDE纳入优先审评。
3.抗体鼻喷雾剂预防新冠感染临床前结果积极。优瑞科生物公布其正在开发的InvisiMask™ 人源抗体鼻喷雾剂预防新冠病毒SARS-CoV-2感染的小鼠模型临床前研究结果。数据显示,该喷雾剂可为接触SARS-CoV-2假型病毒(pseudotyped virus)感染的小鼠提供至少10小时的保护效果,而且在临床前研究中未观察到不良反应。该公司计划向FDA递交新药临床试验申请,进一步开展InvisiMask鼻喷雾剂的临床试验。
4.安斯泰来ADC疗法在中国获批临床。安斯泰来「注射用 enfortumab vedotin」获国家药监局两项临床试验默示许可,拟开发用于局部晚期或转移性尿路上皮癌患者。这是一款靶向Nectin-4的“first-in-class”抗体偶联药物(ADC),曾获FDA授予的突破性疗法认定和优先审评资格,已于2019年底在美国获批上市,用于治疗局部晚期或转移性尿路上皮癌患者,这些患者曾经接受过铂基化疗和PD-1/PD-L1抑制剂的治疗。
5.贝达药业1类抗癌新药BPI-43487获批临床。贝达药业新型FGFR4口服小分子抑制剂 BPI-43487胶囊获CDE批准临床,拟用于FGF19扩增的肝细胞癌(HCC)、胆管细胞癌等实体瘤的治疗。BPI-43487是贝达药业自主研发的拥有完全自主知识产权的新分子实体化合物。当前,针对FGF19扩增的HCC患者治疗的FGFR4抑制剂均处于早期临床阶段,其中,同类品种BLU-554(基石)和Roblitinib(诺华)研发进展最快,处于临床I/II期。
6.新旭生技与渤健达成合作许可协议。新旭生技宣布已授权渤健在全球非排他范围内使用其tau蛋白PET示踪剂18F-APN-1607,以深入研究神经退行性疾病。APN-1607具有在多种tau蛋白病变相关的疾病(阿尔兹海默症、进行性核上性麻痹症和皮质基底节变性症等)中造影出tau蛋白变异的功能。目前双方已针对识别变异tau蛋白在脑部堆积的位置和数量而合作开发新型PET示踪剂,这项授权标志着双方的伙伴关系进一步深化。
国际药讯
1.创新外用疗法Klisyri治疗光化性角化病获FDA批准。FDA批准Athenex和Almirall公司联合开发的微管抑制剂Klisyri(tirbanibulin)1%软膏上市,用于局部治疗面部或头皮的光化性角化病(AK)。光化性角化病是一种因为皮肤暴露在紫外线下导致的皮肤癌前病变。两项关键性Ⅲ期临床数据显示,与赋形剂相比,tirbanibulin治疗组第57天时面部或头皮病灶完全清除的患者数量显著提高。
2.ViiV公布Dovato疗法三项研究数据。ViiV Healthcare在HIV2020会议上公布双药疗法Dovato(拉米夫定/多替拉韦片)TANGO研究的96周数据和两项III期研究(GEMINI 1&2)的三年数据。TANGO研究数据显示,在已实现病毒学抑制且先前未经历病毒学失败的HIV-1成人患者中,与继续使用基于富马酸替诺福韦酯(TAF)的多药方案(至少含三种药物)相比,两药方案Dovato继续显示出非劣效性,两组病毒学失败的患者比例分别为0/369(0%)和3/372(<1%),没有患者在失败时产生耐药性突变。
3.武田布地奈德口服混悬剂获优先审评资格。FDA受理武田制药糖皮质激素布地奈德(budesonide)口服混悬剂TAK-721的新药申请,用于治疗嗜酸性粒细胞性食管炎。FDA同时授予其优先审评资格。如果获批,TAK-721有望成为FDA批准的首个治疗这类慢性炎症性疾病的药物。在两项关键性Ⅲ期临床试验(ORBIT1和ORBIT2)中,试验结果显示TAK-721能够显著提高患者的组织学应答率和显著降低嗜酸性粒细胞计数。
4.新型强效AAK1抑制剂获FDA快速通道资格。Lexicon公司强效非成瘾性小分子转接物关联激酶1 (AAK1)抑制剂LX9211获FDA授予快速通道资格,用于治疗糖尿病周围神经痛。临床前研究表明在不影响阿片通路神经疼痛模型中,LX9211显示出中枢神经系统渗透性和疼痛减轻作用。目前,LX9211治疗糖尿病周围神经痛的II期概念验证性临床正处于受试者招募阶段;治疗疱疹后遗神经痛的II期临床即将启动。
5.礼来拟收购基因疗法公司Prevail。礼来宣布将以10.4亿美元收购Prevail Therapeutics。Prevail致力于为神经退行性疾病患者开发AAV9基因疗法。通过收购,礼来将获得Prevail临床期产品PR001和PR006,以及临床前期产品PR004和阿尔茨海默病、帕金森病、肌萎缩侧索硬化和其他神经退行性疾病的潜在基因疗法。PR001拟用于治疗携带GBA1突变的帕金森病和神经元病性戈谢病患者;PR006拟用于治疗携带GRN突变的额颞叶痴呆患者。
医药热点
1.“互联网+护理服务”试点范围扩大。国家卫健委15日发文,要求进一步扩大“互联网+护理”试点范围。原明确的试点省份按要求继续开展试点,其他省份原则上至少确定1个城市开展“互联网+护理服务”试点工作。《通知》强调,各地卫健行政部门要统筹区域医疗资源,合理引导医疗机构增加护理服务供给。将“互联网+护理服务”与家庭医生签约、家庭病床、延续性护理等服务有机结合,为群众提供个性化、差异化的护理服务。
2.江苏新冠疫苗采购,中标价200元/支。江苏省公共资源交易中心公布关于新型冠状病毒疫苗采购结果的通知,北京科兴中维生物技术有限公司以及北京生物制品研究所有限责任公司新型冠状病毒灭活疫苗(Vero细胞)中标, 中标价均为200元/支(0.5ml)。
3.新疆减免药械注册费1590余万元。为帮助药品、医疗器械产业应对新冠肺炎疫情冲击,新疆维吾尔自治区日前大力开展减负惠企行动。经新疆药监局统计,截至目前,2020年新疆已减免药品、医疗器械产品注册收费1590余万元。自1月1日起,新疆药品注册费、医疗器械产品注册费收费标准降为零。疫情期间,新疆药监局受理首次注册医疗器械品种74个、许可事项变更15个、登记事项变更4个,所有事项均免除费用。
4.西班牙约9.9%人口感染过新冠病毒。西班牙卫生部和卡洛斯三世卫生研究所15日公布的该国第四轮血清学研究结果,自新冠肺炎疫情大流行以来,西班牙全国约9.9%的人口(相当于470万人)已感染过新冠病毒。该数据比起2020年6月血清学研究结果显示的5.2%阳性率增加了4.7个百分点。本轮血清抗体检测共有来自西班牙所有大区和直辖市的51409人参与,其中马德里、昆卡、索里亚三个中部省份的阳性率最高,超过了18%。
股市资讯
【复星医药】复星医药产业与BioNTech签订《许可协议修正案一》与《供货协议》,达成如下约定:BioNTech以成品供货则复星医药产业、BioNTech按65%、35%的比例分享年度销售毛利,以大包装制剂则按60%、40%的比例分享;承诺于2021年向中国大陆供应不少于10,000万剂的mRNA新冠疫苗;首批5,000万剂mRNA新冠疫苗订单的付款安排为首期首付款12,500万欧元+剩余首付款12,500万欧元+按年结算的余款。
【润都股份】公司产品“厄贝沙坦氢氯噻嗪片”的注册申请办理状态已变更为“审批完毕-待制证”阶段。
【新产业】公司化学发光试剂产品“TSH (CLIA) 促甲状腺素测定试剂盒”,“CA 19-9 (CLIA) 糖类抗原19-9测定试剂盒”收到了由欧盟公告机构- TÜV南德意志集团签发的IVDR CE证书,分别用于垂体-甲状腺功能失调的辅助诊断和胰腺癌的辅助管理。
审评动向
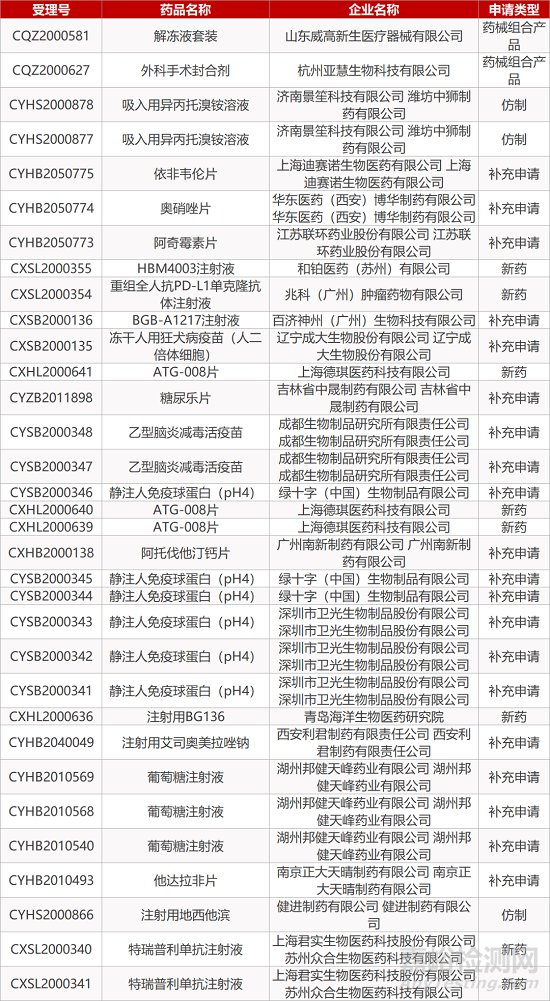
1. CDE最新受理情况(12月16日)
- The End -

来源:药研发


