您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-12 21:02
新药的创新分为以下六种:1)靶点创新,首次发现靶点与特定疾病存在因果关系。通过干预该靶点的生物活性或功能,可以达到治疗该疾病的目的。比如:首次发现PD-1在肿瘤免疫治疗的作用。2)分子实体创新,通过改造和筛选得到与之前发现的同类分子结构具有差异的新分子实体,如继 Keytruda之后上市或在研的PD-1或PD-L1抗体分子。3)治疗方式创新,这是同一生物学靶点,采用不同的干预方式实现疾病治疗的目的,比如针对某一靶点,采用抗体、小分子药物、RNAi、CAR-T等不同的治疗方式。4)用于某一适应症的药物被开发用于治疗另一种新的疾病,比如降糖药利拉鲁肽,增加新适应症治疗肥胖症。5)采用了新的剂型,从而赋予了分子新的治疗效果和安全性,比如由普通片剂,做成缓释片。6)治疗方法创新。典型的例子是联合用药,把几种作用机制不同的药物联合在一起用于某种特定疾病的治疗,如HIV的鸡尾酒疗法,或PD-1抗体联合化疗药物、分子靶向药物、溶瘤病毒、抗体分子的联合疗法。
研发策略的确定
研发策略的确定需要回答三个问题,第一,现有管线如何?第二,未来5-10年的目标是什么?第三,如何达成目标?这是公司层面的问题,需要公司各部门共同去商议,去决策。现有管线分析问题,也就是回答我是谁的问题。比如,如果原来只有非肿瘤管线,需考虑是否扩展到肿瘤领域?非肿瘤和肿瘤产品的比例是多少?现有管线包括的治疗领域/适应症/靶点/研发阶段是怎样的?未来5-10年是否存在GAP? 需要进行GAP 分析。同时需要分析公司的强项在哪里?从哪里入手最有利于扩展管线?如何填补这个GAP? 第二个问题,未来5-10年的目标是什么?这是回答要到哪里去的问题。未来5和10年的治疗领域是什么?多少产品上市?各主要领域和产品对标的公司是?未来5-10年产品的销售预测如何?第三,如何达成目标?这是How的问题。
基于现有管线,寻找未满足临床需求及具有商业吸引力的机会,选择特定的治疗领域,建立影响力。确定是选择自主研发还是BD?如需迅速填补产品缺口,选择BD的方式更为合适。
科学地考量研发策略,首先需要基于现有的治疗领域以及现有产品,选择拟扩展的疾病或适应症进行分析。分析各疾病的流行病学特点是怎样的?标准治疗是什么?临床上未满足的临床需求是什么?MNC或国内领头公司的策略如何?这些分析对于后期是否对新药项目的Go 或 No go的决策很重要。
未满足的临床需求主要有四个方面,临床上发现的疾病无药可治,现有药物在有效性和安全性上存在重大不足,现有药物存在价格过高,对医疗保险及病人经济负担过重,以及现有药物在使用的方式方法上对医生、患者存在巨大的不便利性。基于未满足的临床需求以及患者数,了解疾病领域机会所在。如果疾病患者数多,而且未满足临床需求高,那么机会是比较多的。如果未满足需求很高,但是患者数少,这一点,也不容忽视,比如罕见病,目前监管机构有利好的政策,比如可以加快审评审批,在美国还有减税等政策。
如果一个产品既可以开发大患者群的适应症,同时也能开发罕见病,那么可以考虑先以罕见病上市,大适应症后上市。这需要我们对疾病的病因以及靶点的特点有深刻认识,才能寻找到或者不错过这样的机会。
对于患者数多,或者患者数少,但是未满足需求少,通常不建议。举例说明,一家公司有一个抗栓的产品,在心内科推广的比较好。根据患者数和未满足需求,可以选择进入相邻的治疗领域,比如抗凝或心衰进行项目组合扩展。
项目评估的科学考量
创新项目的评估是一项专业度极高的工作,需要多个部门的协助,进行立体,多层次的信息收集,加工和总结,并最终做出决策。医药创新项目的成功存在巨大的不确定因素,评估工作并不能确保任何项目都成功,但可以有效帮助开发者避免低级错误,降低系统性风险,提高成功的可能性。
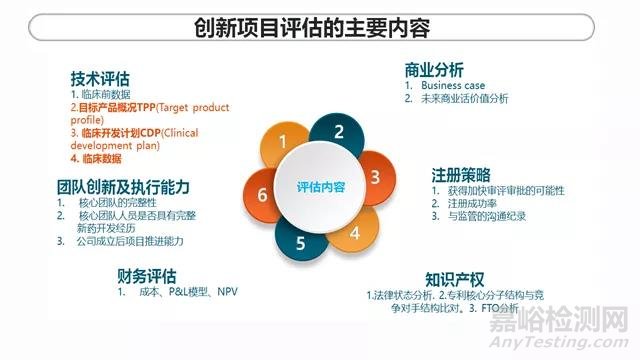
技术评估是项目评估的核心工作。通过对数据的深度挖掘,判断项目数据的真实性和结论的可靠性,分析现有数据是否支持项目的进一步开发或合作,并依据现有数据初步预测未来项目的成功率。
医药研发项目数据可分为临床前数据和临床数据两大的部分。虽然监管机构都出台了相应的临床前和临床数据的开发指南,但在具体的项目评估工作中,我们还是需要通过对数据的总体分析来判断成药性和预测临床成功的可能性。
技术评估中,TPP/CDP/以及临床数据的评估是关键的步骤。项目的医学评估,首先是项目的背景情况分析和总结,分析疾病及适应症背景包括病因/流调/SoC/ 未满足临床需求/现有产品的策略。项目的TPP和CDP是怎样的?需要对项目临床开发数据进行分析和总结,包括了解项目进入到什么阶段了?I期,II期还是III期?越到后期,不确定性越少,成功率越大。研究设计怎样?临床试验记录的完整、真实、可靠?疗效和安全性如何?是否达到首要终点和关键次要临床终点?统计方法是否恰当?其CDP是否能达成TPP?TPP是否需要达到了best case 才有竞争力,如仅满足base case是否就要放弃项目?项目的竞争力分析,这需要协助商业团队做市场及管线竞争分析,需收集收集竞品TPP,并进行比较,评估候选项目是否具有竞争力,和商业团队一起收集KOL的反馈。
下一步,如果评估下来结果比较好,有合作的意向,需要做详细的开发计划,协助注册团队进行注册策略的分析,拟定临床开发计划CDP, 包括生命周期管理,场景分析及策略。最后,基于整体策略从临床角度决定Go/No go?临床价值怎样?是否可以和竞品有效区分?存在的风险如何?获益是否大于风险?这些都是要考虑的。
作为药物临床开发中有效的工具,目标产品概况(TPP)和临床开发计划(CDP)有助于在临床开发中系统的考量科学、商业、临床研究设计、监管部门的要求,以及决策节点的选择及决策标准等,这会极大地提高决策的科学性。
TPP是新药开发的明确目标,是制定CDP的基础,而CDP是达到TPP所规划目标的线路图。TPP秉承“以终为始”的开发理念,确保开发项目效率的同时,通过对未来产品特点的具体描述,为其临床开发计划设计“愿景”。最理想的状况是与最后申报NDA的药品说明书一致,虽然很难做到毫无偏移,但制定TPP不仅有助于对未来可能面临的临床结果预先设定“生杀”标准,也有助于跨部门沟通与团队共建。CDP参照科学及商业依据布局,需要多学科、多个团队通过不懈思索与努力,花费大量时间和精力来制定、实施、评估,是新药临床开发中的重要文件。
TPP的内容包括基本信息,MOA,开发适应症,给药方式,给药剂量,给药周期,疗效预期,安全性预期,注册路径, PTS(技术成功概率)。TPP是动态的,不是一成不变的,随科学进展,法规变化,临床前及临床数据累积进行更新和修订。
CDP整合临床,临床前及CMC整合的开发路径;临床的内容涵盖从I期到II期POC,到关键III期临床的研究设计,研究终点,样本量,观察时间,以及期中和最终分析的timeline, 此外,临床试验过程中,会有药学的变更,或是重大变更,或是一般变更,是否药学研究比对研究足够?还是需要动物研究甚至临床桥接研究?这些都是需要考量的。
除了技术层面的评估以外,还需要进行以下几方面的评估。商业评估, 商业团队做business case, 进行更深入的分析,与更多的KOL进行相关的调研,对产品未来商业化的价值给一个明确的销售预测。注册策略评估包括项目获得加快审评审批的可能性;注册成功率以及与监管的沟通纪录;知识产权评估包括:1)法律状态分析:如优先权日、审查阶段、进入国家、专利权归属等。2)专利核心分子结构与竞争对手结构比对。3)FTO分析:专利要求,竞争对手类似权利要求,可能侵权分析。
财务评估,财务会从成本的角度,比如开发成本,合作成本等,根据成本数据,财务会做一个P&L(profit & loss)模型,这个模型会对产品在上市后整个的生命周期进行P&L的预测,可能会从上市一直到专利过期,通常是可能8~10年左右的整个产品生命周期的p&l的预测。财务也会用另外一个财务模型叫 NPV net presents value净现值模型。这个财务模型就是每年的 p&l的数值折成目前的现金流进行的一个测算。这个NPV会决定了我们合作的项目的价值。通过NPV的这个值可以帮助管理层在判断这个项目是否值得往下继续推进。
团队的创新和执行力评估,可从以下3个方面着手:1)核心团队的完整性:即公司的高管团队是否涵盖了早期研发、临床前开发、临床开发甚至生产、销售的核心环节。2)核心团队人员是否具有完整新药开发经历。3)公司成立后项目推进能力:是否在特定的时间段内完成了公司项目价值提升,如获得临床候选物、完成临床前开发或进入临床等。
案例分析
下面介绍一个失败的案例:2020年年底,由于GALACTIC试验失败, 安进砍掉合作达十多年的心衰新药项目,归还给Cytokinetics。安进为何有这个合作?又为何砍掉这个项目?安进的心血管产品包括降脂药,evolocumab,以及心衰药Ivabradine,一个与施维雅合作的于2015年获批的产品。而Cytokinetics的药物OM,是这个靶点开发最快的。它具有独特的作用机制,选择性心脏肌球蛋白激活剂,加心肌收缩持续时间、改善心肌功能、并提高泵血能力,具有first in class 的潜力,有可能成为安进心血管领域生命周期管理重要的组成部分。
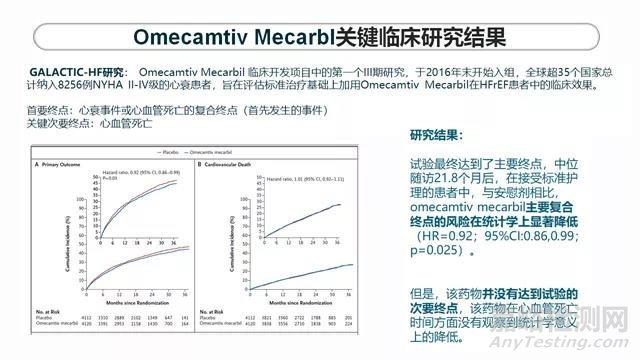
心衰领域的疾病情况是这样的:流行病学方面,慢性左心衰患病率为1.5%~2.0%,≥70岁人群患病率≥10%,心衰患病率呈不断上升的趋势。心衰是各种心脏疾病的严重表现或晚期阶段,死亡率和再住院率居高不下,在中国,住院心衰患者的病死率为4.1%。58.9%患者会在出院后2周内再次入院, 12.5%的心衰住院患者会在出院后30天内再次入院。心衰存在很大的未满足的临床需求:目前药物仅改善患者症状,对心脏损伤无明显改善,无法控制病情进展。对于终末期心衰患者,心脏移植是目前唯一有希望的治疗选择,而中国目前至少有10万例心衰患者急需心脏移植,但每年开展的心脏移植手术仅几百例。标准治疗是肾素血管紧张素系统抑制剂ACEI/ARB,Beta blocker和醛固酮受体拮抗剂是治疗慢性心衰的金三角。近几年获批的产品包括脑啡肽酶/ACE抑制剂;SGLT-2抑制剂;可溶性鸟苷酸环化酶激动剂。可以看到,药物研发或BD这个心衰的领域是有充分的理由的。OM的CDP,有11个1期临床研究,300例受试者,对PK/PD 特征探索得比较充分,7个2期临床研究,1400个受试者,对剂量进行探索。另外还有两个大样本量的III期临床研究,GALACTIC-HF研究以及METEORIC-HF研究。GALACTIC-HF研究是OM临床开发项目中的第一个III期研究,2016年末开始入组,全球超35个国家总计纳入8256例NYHA II-IV级的心衰患者,目的是评估标准治疗基础上加用OM在射血分数降低的心衰患者中的临床效果。首要终点是心衰事件或心血管死亡的复合终点(首先发生的事件)。关键次要终点是心血管死亡。试验达到了主要终点。中位随访21.8个月后,在接受标准护理的患者中,与安慰剂相比,OM在主要复合终点的风险在统计学上显著降低(HR=0.92;p=0.025)。正常情况下,达到临床试验的主要疗效终点就被认为是一个胜利。但是,该药物并没有达到试验的次要终点,在心血管死亡时间方面没有观察到统计学意义上的降低。
这个项目失败的原因有几个考量。首先,关键首要终点未达成科学层面的可能原因:第1,是否存在难以避免的失败的原因?OM作用靶点的基础研究尚未充分,这个靶点对心衰是否有因果关系尚待更多的数据去证明。由于对于疾病复杂的病因没有充分的了解或缺乏可预测的临床前体内和体外有效性模型引起的失败的难以避免的。激活心脏肌球蛋白这通路是否是因为缺乏足够的科学进展或证据而导致的未能达成降低心血管死亡率而失败?如自主研发,BD也是存在不确定性,BD越早进入,风险越高,越往后,风险越低,但是成本会更高。
第2,是否存在可以避免的失败的原因:设计层面:受试者的选择是否恰当?剂量选择是否准确?或者还有其它原因?执行层面:是否存在一些运营方面的问题?其次,商业层面原因:首要终点达成,但关键次要终点未达成,没有达到预先设定的TPP。相比降低风险,公众更关注降低死亡率,而没有达到次要终点就让人对这款药物的发展前景产生质疑。而竞品诺华的Entresto ent以及阿斯利康的达格列净皆证明可降低心血管死亡。即使上市,也不会有优势,No go是最佳的选择。因此,安进终止这个项目。
新药研发策略的确定和项目评估需多部门共同合作,科学考量是关键。TPP/CDP是重要的分析和评估工具,并且需深入和客观的分析研究资料,靶点的基础研究是否充分,早期和晚期研究的设计如何,分析病人、剂量和研究终点的选择是否合理,并且关注疗效和安全性包括免疫原性等等。
参考文献
1.创新医药项目的核心价值评估。
https://mp.weixin.qq.com/s/qM44Oiaah12jDExifkQZRw
2.Cardiac Myosin Activation with Omecamtiv Mecarbil in Systolic Heart Failure. N Engl J Med. 2021 Jan 14;384(2):105-116

来源:生物制药小编


