您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-07 14:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
毛果芸香碱治疗老花眼获批Ⅲ期临床。极目生物毛果芸香碱制剂ARVN003获国家药监局临床试验默示许可,即将开展用于治疗老花眼的Ⅲ期临床。这也是中国批准的第一项老花眼药物临床试验,该试验将评估ARVN003对暂时性改善老花眼患者近视力的疗效和安全性。在海外,该新药已于2021年5月取得Ⅲ期研究VISION-1积极结果,目前正在准备进行第二项Ⅲ期临床试验VISION-2。
国内药讯
1.绿叶「戈舍瑞林微球制剂」Ⅲ期临床积极。绿叶制药创新制剂注射用醋酸戈舍瑞林缓释微球(LY01005)治疗前列腺癌的Ⅲ期临床达到预设终点。3.6mg LY01005(每28天肌肉注射一次)在有效控制睾酮至去势水平方面与对照药物相当;注射部位不良反应较对照药物显著改善,患者顺应性增加,其他不良事件发生率相似,安全性特征相近,整体临床安全耐受性良好。目前, LY01005也在Ⅲ期临床中评估治疗乳腺癌的潜力。
2.甘莱FXR激动剂治疗PBC报IND。歌礼旗下甘莱制药非甾类FXR激动剂ASC42的临床试验申请获CDE受理,拟用于原发性胆汁性胆管炎(PBC)患者的治疗。ASC42已在美国开展的I期临床中取得良好的安全性和药效学生物标志物顶线数据。在人体有效剂量15mg、每日1次、为期14天的治疗过程中,未观察到瘙痒症状且FXR靶向激活的生物标志物成纤维细胞生长因子19(FGF19)在给药第14天时的增幅高达1632%。
3.CGRP单抗防治偏头痛Ⅲ期临床积极。礼来CGRP单抗Emgality(galcanezumab)预防性治疗成人发作性偏头痛的国际Ⅲ期临床达到主要终点。CGAX研究入组人群以中国患者为主。结果显示,与安慰剂组相比,galcanezumab治疗组每月头痛天数显著减少;在四个评估偏头痛对功能影响的关键次要终点方面,治疗组也优于安慰剂组,与全球已完成的主要研究结果一致;而且,galcanezumab具有良好的安全性。
4.新一代庞贝病疗法在华获批临床。赛诺菲1类新药avalglucosidase alfa获国家药监局临床试验默示许可,拟开发用于早发型庞贝病患者的治疗。avalglucosidase alfa是一款酶替代疗法,通过靶向M6P受体,来增强GAA向肌肉细胞溶酶体中的递送。2021年8月,FDA已批准该新药上市(商品名:Nexviazyme),用于治疗1岁及以上的晚发性庞贝病患者。
5.杭州葆元AB-106报IND。葆元生物自主研发的1类新药AB-106胶囊的临床试验申请获CDE受理。AB-106是新一代的双靶点抑制剂,对ROS1及NTRK1-3具有显著的抑制活性。临床前研究表明AB-106安全性好,应答率高,对ROS1或NTRK融合突变肿瘤均有很好的抑制效果,被视为新一代广谱抗癌分子。目前,AB-106已在国内登记启动了2项药物相互作用的I期临床,以及2项实体瘤的II期临床试验。本次IND预计为针对新适应症的II期临床试验。
国际药讯
1.TSLP靶向哮喘新药Ⅲ期临床积极。安进靶向TSLP的FIC抗体疗法tezepelumab,在治疗重度哮喘的关键性Ⅲ期临床NAVIGATOR中获积极数据。探索性分析显示,在伴有鼻息肉的严重哮喘患者中,tezepelumab联合标准治疗将每年哮喘急性加重率(AAER)降低86%(95% CI: 70, 93);在无鼻息肉的严重哮喘患者中,这一数值为52%(95% CI: 42, 61)。两组在第52周时将使用支气管扩张剂之前的一秒用力呼气量(FEV1)分别提高0.20公升(伴有鼻息肉)和0.13公升(无鼻息肉)。目前,它的新药申请已被FDA授予优先审评资格。
2.口服NHE3抑制剂Ⅲ期结果公布。Ardelyx公司NHE3抑制剂tenapanor用于慢性肾脏病透析患者治疗的Ⅲ期PHREEDOM研究结果发表于《Kidney360》杂志上。数据显示, tenapanor治疗组患者的平均血清磷从基线时的7.7mg/dL下降到26周治疗期结束时的5.1mg/dL,tenapanor组和安慰剂组之间血清磷水平的估计平均变化差异为−1.4mg/dl(p<0.0001)。安全性方面,与药物相关的不良事件为腹泻(超过5%),并导致16%的患者停药。
3.TCR-T疗法早期临床积极。Adaptimmune公司在ILCA2021年会上公布其AFP靶向TCR-T细胞疗法治疗晚期肝细胞的Ⅰ期临床ADP-A2AFP最新结果。在接受目标剂量治疗的13例患者中,1例患者获得完全缓解,6例患者疾病稳定,疾病控制率为64%(7/11);2例疾病稳定的患者持续时间超过16周;ADP-A2AFP表现出可接受的安全性特征,没有报告出现显著T细胞相关肝脏毒性和限制剂量的毒性。
4.Anixa治疗卵巢癌CAR-T获批临床。Anixa Biosciences自主研发的自体CAR-T疗法获FDA临床试验默示许可,拟临床用于卵巢癌的治疗。该疗法通过CAR-T技术特异性靶向卵巢细胞表面的促卵泡激素受体(FSHR)的蛋白受体。除了在成熟女性卵巢细胞表达外,研究团队也在其他类型的肿瘤血管上观察到FSHR的表达。目前,除了B细胞恶性肿瘤外,尚未有针对实体瘤的CAR-T产品获批上市。
5.心力衰竭RNA疗法公司完成B轮融资。Cardior公司完成6400万欧元(约7600万美元)的B轮融资,以推进其靶向非编码RNA(ncRNAs)的RNA疗法CDR132L进入Ⅱ期临床。CDR132L是一种高度稳定的水溶性寡核苷酸ncRNAs抑制剂,旨在阻断心力衰竭患者心脏中异常的micro-RNA-132,从而逆转细胞病理学并恢复心肌细胞的正常功能,有助于改善心力衰竭患者的心脏收缩和舒张功能。
6.Atavistik拟开发别构调节药物。Atavistik Bio公司完成6000万美元的A轮融资。Atavistik联合创始人Jared Rutter博士是研究蛋白代谢产物方面的专家,基于Jared Rutter博士研究的技术平台能够快速筛选与目标蛋白别构结合的代谢产物。此轮融资将用于支持Atavastik药物发现平台的开发,以及针对受到代谢产物别构调节的疾病相关信号通路,发现治疗代谢疾病和癌症候选药物。
医药热点
1.北京支持8类疾病开展干细胞治疗。北京市卫健委日前发布《首都卫生发展科研专项2022年申请指南》。该指南以健康需求为导向,明确鼓励支持针对8类疾病开展干细胞治疗研究,包括:神经系统疾病、骨科疾病、呼吸系统疾病、普通外科疾病、血液系统疾病、整形医学、风湿免疫疾病、皮肤与性病。各疾病均有具体的研究方向与重点,由市财政专项经费支持。
2.中国首个mRNA新冠疫苗工厂交付。9月1日,中国首个mRNA新冠疫苗模块化工厂建成交接仪式在云南玉溪沃森疫苗产业园现场隆重举行。该工厂由森松集团设计与承建,建筑面积超过5000平方,总建设周期历史7个半月,为国内首个采用EPC模块化建造的mRNA疫苗厂房。该工厂满足WHO与NMPA的GMP要求,能够合规地进行mRNA疫苗的质粒生产、原液与制剂制备、产品灌装等全工艺过程作业。
3.海南村卫生室十项远程服务纳入医保。海南省卫健委、医保局近日联合发文,从9月15日起,该省村卫生室可开展常规心电图检查、动态心电图、胎心监测、葡萄糖测定、尿常规检查、糖化血红蛋白测定、血清总胆固醇测定、血清甘油三酯测定等10项远程医疗服务项目,价格按照一级医疗机构三类价的80%收费,并纳入医保报销。
评审动态
申请临床:
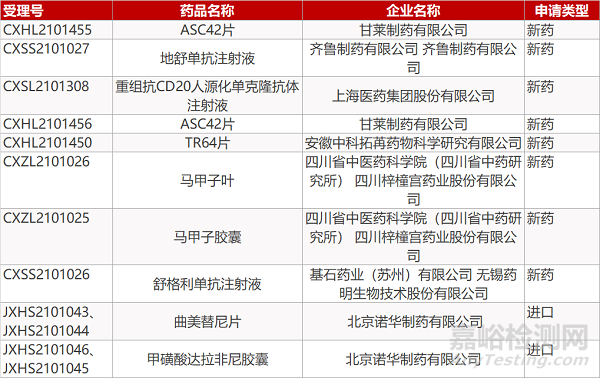
甘莱制药的ASC42片(2个规格)、上海医药的重组抗CD20人源化单克隆抗体注射液、安徽中科拓苒药物公司的TR64片、四川省中医药科学院/四川梓橦宫药业的马甲子叶和马甲子胶囊。
申请生产:
齐鲁的地舒单抗注射液、基石药业/无锡药明生物的舒格利单抗注射液、诺华的曲美替尼片(2个规格)和甲磺酸达拉非尼胶囊(2个规格)。

来源:药研发


