您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-10 10:17
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
再鼎TPX-0022国内报IND。再鼎医药1类新药TPX-0022的临床试验申请获CDE受理。TPX-0022是Turning Point Therapeutics开发的一款口服MET/CSF1R/SRC激酶抑制剂,再鼎拥有该药在大中华区的开发和商业化的独家授权。据悉,TPX-0022已于2019年6月首次在国外启动了针对MET/HGF或CSF1R/SCF1R突变的晚期或转移性实体瘤患者的Ⅰ期临床SHIELD-1研究。此次为首次在国内申报临床。
国内药讯
1.普拉替尼治疗NSCLC中国队列结果积极。基石药业在2021 IASLC WCLC会议上公布了选择性RET抑制剂普吉华®(普拉替尼胶囊)治疗晚期RET融合阳性非小细胞肺癌(NSCLC)国际I/II期研究ARROW(NCT03037385) 中国队列的积极数据。在经治患者中,确认的ORR为66.7%, DCR为93.9%,首次缓解的中位时间为1.89个月;在初治患者中,确认的ORR为80%, DCR为86.7%,首次缓解的中位时间为1.87个月。普吉华®在中国患者中整体安全可控,没有发现新的安全信号。
2.福瑞他恩治疗脱发II期临床积极。开拓药业福瑞他恩(酊剂)治疗雄激素性脱发的中国II期临床达主要终点。与安慰剂组相比,福瑞他恩治疗组第24周时目标区域内非毳毛数量与基线的变化显著提高;临床中大多数不良事件为轻度,且未出现严重不良事件。5毫克(0.5%)福瑞他恩被确定为中国III期临床的剂量,预计今年第四季度启动该项III期临床。
3.康辰KC1036治疗实体瘤早期临床积极。康辰药业潜在“first-in-class” AXL/VEGFR2/FLT3小分子靶向抗肿瘤药物KC1036,在用于治疗晚期实体瘤患者的Ⅰ期临床中结果积极。在可评估的15例患者中,客观缓解率(ORR)为13.3%,疾病控制率(DCR)为80%;2例部分缓解受试者持续缓解时间已达到3个月。在剂量递增阶段,尚未观察到剂量限制性毒性(DLT)反应。KC1036单药显示出良好的安全性及耐受性。
4.CRISPR/Cas9基因编辑疗法上Ⅰ期临床。博雅辑因旗下造血干细胞基因编辑疗法ET-01用于治疗输血依赖型β地中海贫血的Ⅰ期注册性临床完成首例患者入组。该项试验主要研究者为中国医学科学院血液病医院再生医学诊疗中心主任、教授施均博士和南方医科大学南方医院儿科教研室主任吴学东医学博士。ET-01是一款CRISPR/Cas9基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液,也是国内首个获准开展临床的基因编辑疗法和造血干细胞疗法。
5.百奥泰贝伐珠单抗海外授权。百奥泰宣布与诺华子公司Sandoz签订授权许可协议,将贝伐珠单抗生物类似药BAT1706注射液在美国、欧洲、加拿大和大部分其它BAT1706合作未覆盖的国际市场的产品商业化权益授权给Sandoz。百奥泰将获首付款及里程碑款总金额最高至1.55 亿美元,其中包括2750万美元首付款、可能达1.275亿美元里程碑付款和销售分成。去年8月,百奥泰已将该产品的中国地区权益授权给百济神州。
国际药讯
1.NASH突破性疗法启动关键性Ⅲ期临床。Inventiva公司口服泛PPAR激动剂lanifibranor启动用于治疗非酒精性脂肪性肝炎(NASH)的关键Ⅲ期临床NATiV3。在Ⅱb期临床中,1200 mg lanifibranor在ITT患者群中显著降低患者的肝细胞炎症和肝细胞气球样变的SAF评分(同时肝纤维化程度没有恶化),达主要终点的患者比例为49%(安慰剂组:27%,p=0.004)。FDA已授予lanifibranor用于治疗NASH的突破性疗法认定。Inventiva计划通过加速批准通道递交新药申请。
2.PLK1抑制剂治疗结直肠癌Ⅰ/Ⅱ期临床积极。Cardiff Oncology公司PLK1抑制剂onvansertib与Folfiri、Avastin(bevacizumab)构成的组合方案,在治疗携带KRAS突变的转移性结直肠癌(mCRC)经治患者的Ⅰ/Ⅱ期临床获积极结果。在接受Ⅱ期推荐剂量治疗的19例患者中,ORR达到42%(标准化疗历史数据:ORR只有5-13%)。onvansertib治疗患者中位PFS为9.4个月(标准化疗历史数据:中位PFS为4.5-5.7个月),接受Ⅱ期推荐剂量治疗的患者亚群的PFS尚未达到。
3.布美他尼治疗自闭症III期临床失败。施维雅与Neurochlore联合开展的布美他尼用于治疗儿童和青少年自闭症谱系障碍 (ASD) 的两项III期临床未达到主要疗效终点。与安慰剂相比,布美他尼未表现出优越的临床疗效。两家公司已决定提前终止两项正在进行的临床研究。布美他尼是一种强效利尿药,通过抑制钠-钾-氯共转运体(NKCC1)发挥作用,该药已于1983年获FDA批准上市,用于治疗水肿。
4.罗氏合作开发亨廷顿舞蹈症基因疗法。罗氏旗下Spark Therapeutics公司与NeuExcell公司达成一项合作,将利用NeuExcell专有的神经再生基因治疗平台,共同开发一款用于治疗亨廷顿舞蹈症(HD)的基因疗法。NeuExcell神经再生基因治疗平台基于转录因子介导的转化技术而构建,旨在将内源性胶质细胞通过重编程,在原位转化为功能性的新神经元。NeuExcell将获得最高约1.9亿美元的预付、许可费、研发和销售里程碑付款,而Spark将获得HD项目的全球授权。
5.赛诺菲拓展移植药物管线。赛诺菲宣布已与Kadmon Holdings达成约19亿美元的收购协议,并获得Kadmon Holdings公司一款小分子ROCK2抑制剂Rezurock(belumosudil),以补充其移植产品管线。今年7月,FDA已批准Rezurock上市,用于治疗慢性移植物抗宿主病(cGVHD)儿童(12岁及以上)和成人患者。Kadmon也正在开发Rezurock用于治疗弥漫性皮肤系统性硬化症,目前正在一项开放标签的Ⅱ期临床中评估治疗潜力。
6.ADARx Pharmaceuticals完成B轮融资。ADARx公司宣布完成7500万美元的B轮融资。本轮融资将用于推进ADARx靶向mRNA的技术平台,以加速开发用于遗传病、心脏代谢和中枢神经系统(CNS)疾病治疗的RNA靶向疗法。ADARx创新的RNA降解和抑制方法可以模仿人体的自然生物过程,通过寡核苷酸调节基因表达。本轮融资还将用于将其靶向治疗α-1抗胰蛋白酶缺乏症的先导项目推进至临床。
医药热点
1.江苏省74个药品供应价下降。江苏省公共资源交易中心日前发布了《关于调整部分药品供应价格调整的通知》,涉74个药品,自9月9日起执行。据了解,这是2021年以来江苏的第9批降价药品。在这74个调整供应价的药品中,涉及多个常用药,包括六味安神胶囊、上清片、葆宫止血颗粒等。
2.mRNA新冠疫苗安全监测数据出炉。美国各州卫生健康研究中心在国际期刊《JAMA》联合发布了一项关于新冠mRNA疫苗安全性监测的研究报告。该研究主要针对辉瑞-BioNTech的BNT162b2和Moderna的mRNA 1273两款新冠mRNA疫苗,并就这两款疫苗是否与接种后21天内发生严重健康后果的风险增加有关进行了大规模跟踪监测,其研究结果指出,未发现与BNT162b2或mRNA 1273疫苗接种相关的严重健康影响。
3.住院医师培训需落实“两个同等对待”。国家卫健委发布《关于贯彻落实住院医师规范化培训“两个同等对待”政策的通知》,旨在进一步健全住院医师规范化培训制度。“两个同等对待”是指:面向社会招收的普通高校应届毕业生培训对象培训合格当年在医疗卫生机构就业的,在招聘、派遣、落户等方面,按当年应届毕业生同等对待;而对经住培合格的本科学历临床医师,在人员招聘、职称晋升、岗位聘用、薪酬待遇等方面,与临床医学、中医专业学位硕士研究生同等对待。
评审动态
申请临床:
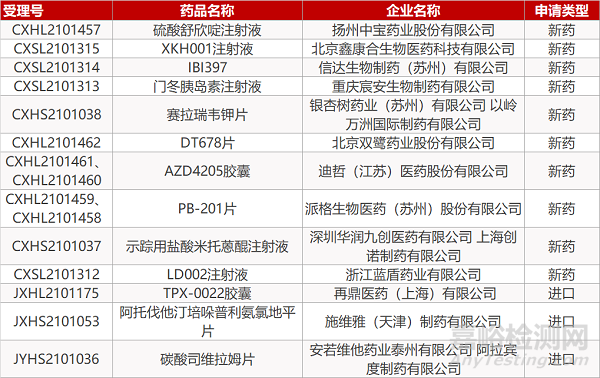
扬州中宝的硫酸舒欣啶注射液、北京鑫康合生物的XKH001注射液、信达生物的IBI397、重庆宸安生物的门冬胰岛素注射液、北京双鹭的DT678片、迪哲(江苏)的AZD4205胶囊(2个规格)、派格生物的PB-201片(2个规格)、深圳华润九创/上海创诺的示踪用盐酸米托蒽醌注射液、浙江蓝盾药业的LD002注射液、再鼎医药的TPX-0022胶囊。
申请生产:
银杏树药业/以岭万洲的赛拉瑞韦钾片、施维雅的阿托伐他汀培哚普利氨氯地平片、安若维他药业/阿拉宾度制药的碳酸司维拉姆片。

来源:药研发


