您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2025-01-16 18:53
FDA的突破性器械项目(Breakthrough Devices Program)是一项自愿参与的计划,旨在加快对突破性技术或能够更有效地治疗或诊断危及生命或不可逆转的衰弱性疾病或病症的技术的审查。据药智医械数据统计,2024年美国FDA已公示获批上市的产品中,突破性器械产品共32款。
从FDA公开信息来看,32款产品的类型集中于无源植入器械,其中以骨科和心血管植入物为主。
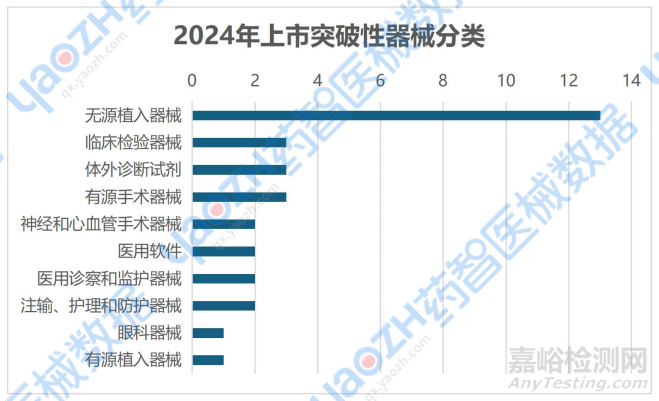
资料来源:美国FDA官网
本文介绍了其中14款植入类器械,具体如下:
1、产品英文名称:GORE EXCLUDER THORACOABDOMINAL BRANCH ENDOPROSTHESIS (TAMBE)
产品中文名称:胸腹分支支架
企业名称:W.L. GORE & ASSOCIATES, INC.
公示日期:2024-01-12
申请号:P230023
适应症范围:胸腹主动脉瘤患者,以及具有高手术风险且患有近肾主动脉瘤的患者。
本产品的主要研究者、匹兹堡大学医学院血管外科主任Michel Makaroun医生针对产品的相关研究表示:“这项早期可行性研究包含TAMBE装置的两种规格。除了原版的顺应型肾分支规格外,还评估了另一种新版的顺应型规格,它允许所有分支从患者手臂开始放置。”
顺应型规格具备产品管身长度更短的特点,与更多患者解剖结构的适配性更高;整合式系统则包含4根预先成型的门式分支,可用于将支架-移植物放置到内脏分支血管。此外,顺应型规格还保留了一套直观的分期放置系统,旨在帮助医生对移植物进行重新定位,并在整个放置过程中辅助各分支的选择性插管。

图片来源:W.L. GORE & ASSOCIATES, INC.官网
2、产品英文名称:EDWARDS EVOQUE TRICUSPID VALVE REPLACEMENT SYSTEM
产品中文名称:经导管三尖瓣置换系统
企业名称:EDWARDS LIFESCIENCES, LLC
公示日期:2024-02-01
申请号:P230013
适应症范围:EVOQUE系统(经导管三尖瓣置换系统)可无需开胸手术且无需同时移除失效的原生三尖瓣的情况下,替代原生三尖瓣。
EVOQUE系统系统包括EVOQUE瓣膜、EVOQUE三尖瓣输送系统、EVOQUE扩张器套件、EVOQUE装载系统,以及各种可选附件。其中,EVOQUE瓣膜由一个28毫米的三片牛心包组织瓣膜组成,配有一个带锚定系统的自扩展镍钛合金框架。该框架能够延伸至心腱索装置之间,以固定并捕捉原生三尖瓣瓣叶(隔瓣、前瓣和后瓣)的自由边缘。此外,瓣膜还配备了一个环内织物裙边。
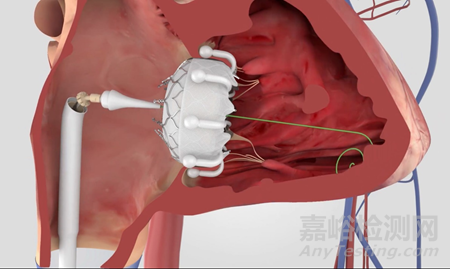
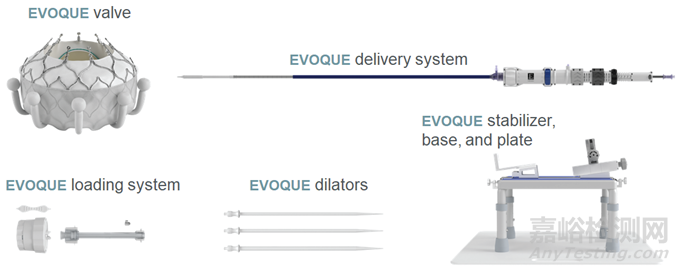
图片来源:EDWARDS LIFESCIENCES, LLC官网
3、产品英文名称:VADER PEDICLE SYSTEM
产品中文名称:VADER椎弓根系统
企业名称:ICOTEC AG
公示日期:2024-02-26
申请号:K232628
适应症范围:恢复脊柱的完整性。VADER椎弓根系统旨在作为融合的辅助手段,用于稳定胸椎和/或腰椎,适用于因感染(如脊椎盘炎、骨髓炎)或手术清创、减压引起的脊柱不稳定的患者。
ADER椎弓根系统由其独有的BlackArmor®碳纤维增强聚醚醚酮复合材料组成。在涉及胸椎和腰椎的晚期肿瘤患者中,即使患者在接受肿瘤治疗之前的预期寿命不足以实现融合,该产品也能在有限的时间内恢复脊柱的功能。VADER椎弓根系统可为外科医生提供一种最小侵入性和开放式的后路脊柱手术方法。


图片来源:ICOTEC AG官网
4、产品英文名称:AGENT PACLITAXEL-COATED BALLOON CATHETER
产品中文名称:紫杉醇涂层球囊导管
企业名称:BOSTON SCIENTIFIC CORPORATION
公示日期:2024-02-29
申请号:P230035
适应症范围:AGENT紫杉醇涂层球囊导管适用于在适当的血管准备后,用于接受经皮冠状动脉介入治疗(PCI)的成年患者,治疗直径为2.0 mm至4.0 mm、长度不超过26 mm的冠状动脉病变,以改善治疗支架内再狭窄(ISR)。

图片来源:BOSTON SCIENTIFIC CORPORATION官网
5、产品英文名称:ANKLE TRUSS SYSTEM (ATS)
产品中文名称:踝关节支架系统
企业名称:4WEB MEDICAL, INC.
公示日期:2024-03-21
申请号:K230088
适应症范围:踝关节支架系统(ATS)是一种永久植入产品,旨在为胫距跟融合钉提供机械支撑,用于在踝关节融合术或踝关节置换术失败后进行的挽救手术中,帮助融合胫距跟关节,适用于有肢体丧失风险的患者。
ATS 装置由钛合金(Ti6Al4V)制成,具有球形或立方体形状结构。该产品采用开放式结构支架设计,在整个植入物中提供支撑,同时还可保留开放空间以促进融合。

图片来源:4WEB MEDICAL, INC.官网
6、产品英文名称:CERAMENT G
产品中文名称:骨缺损填充剂
企业名称:BONESUPPORT AB
公示日期:2024-03-24
申请号:K234008
适应症范围:CERAMENT G是一种可植入的骨缺损填充剂(药械组合产品),用于作为全身抗生素治疗和手术清创(骨感染的标准治疗方法)的辅助治疗,适用于需要补充骨移植的情况。
本产品由羟基磷灰石、硫酸钙和庆大霉素组成,与已通过DEN210044批准的产品完全相同。本次申请扩展了产品的适应症,具体为适用于需要骨缺损填充的开放性骨折患者的使用。

图片来源:BONESUPPORT AB官网
7、产品英文名称:TRICLIP G4 SYSTEM
产品中文名称:三尖瓣修复系统
企业名称:ABBOTT MEDICAL
公示日期:2024-04-01
申请号:P230007
适应症范围:TriClip G4系统旨在通过抓取并靠拢(三叶瓣对合)三尖瓣瓣叶,以减少三尖瓣反流 (TR),实现无需开胸手术而修复原生三尖瓣。
本产品由TriClip可操控导管 (SGC)、TriClip G4递送系统 (TDS) 和配件组成。
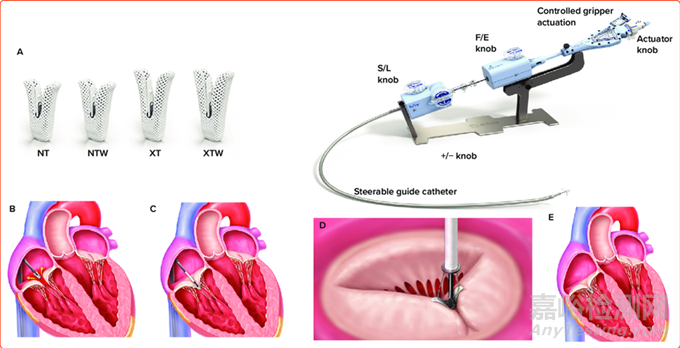
图片来源:ABBOTT MEDICAL官网
8、产品英文名称:KONG-TL VBR SYSTEM AND KONG C VBR SYSTEM
产品中文名称:椎体置换系统
企业名称:ICOTEC AG
公示日期:2024-04-04
申请号:K232790
适应症范围:KONG-TL系统适用于胸腰椎(T1至L5),用于替代因肿瘤或创伤(如骨折)导致塌陷、损伤或不稳定的椎体。KONG-C系统设备适用于骨骼发育成熟的患者的颈椎(C2至T1),用于替代因肿瘤、骨折或骨髓炎导致病变或损伤的椎体,或用于在颈椎退行性疾病中为实现脊髓和神经组织的减压而进行椎体切除术后的重建。
两款装置均使用包含特殊钛涂层的BlackArmor®碳纤维增强聚醚醚酮制备而成。


图片来源:ICOTEC AG官网
9、产品英文名称:ICOTEC INTERBODY CAGE SYSTEM (ICOTEC CERVICAL CAGE, ICOTEC PLIF LUMBAR CAGE, ICOTEC ETURN TLIF LUMBAR CAGE)
产品中文名称:椎间融合器系统
企业名称:ICOTEC AG
公示日期:2024-04-05
申请号:K232792
适应症范围:本产品适用于骨骼成熟的患者,在一个或多个椎间水平(C2-T1)进行脊柱融合手术。
icotec椎间融合器系统由碳纤维增强聚醚醚酮材料制成,并带有粗糙的钛涂层。该产品系列包括一种颈椎融合器和两种腰椎融合器。



图片来源:ICOTEC AG官网
10、产品英文名称:ESPRIT BTK EVEROLIMUS ELUTING RESORBABLE SCAFFOLD SYSTEM
产品中文名称:依维莫司洗脱可吸收支架系统
企业名称:ABBOTT MEDICAL
公示日期:2024-04-26
申请号:P230036
适应症范围:Esprit BTK支架是一个可吸收的聚左旋乳酸支架,具有药物和可吸收聚合物涂层,随着时间的推移被吸收。该产品用于治疗膝下动脉阻塞或重症肢体缺血(CLI)的外周动脉疾病(PAD)晚期患者。
Esprit BTK依维莫司洗脱可吸收支架系统由一个球囊扩张支架和一个输送系统组成。

图片来源:ABBOTT MEDICAL官网
11、产品英文名称:ICOTEC ANTERIOR CERVICAL PLATE SYSTEM
产品中文名称:前路颈椎固定板系统
企业名称:ICOTEC AG
公示日期:2024-05-17
申请号:K233215
适应症范围:icotec前路颈椎固定板系统由碳纤维增强聚醚醚酮材料制成,带有钽标记,该系统专为颈椎的常规前路手术设计。
据公开资料显示,icotec前路颈椎固定板系统提供多种板长,并配有自攻螺钉,以适应患者的特定解剖结构。固定板宽度为18毫米,可选择1至4节段的植入物,长度范围为21毫米至94毫米。固定板预弯曲从而可贴合患者的解剖结构,板上的螺钉孔为锥形并带有螺纹。
icotec前路颈椎固定板系统的自攻螺钉有4.0毫米和4.25毫米两种直径,以及13毫米和15毫米两种长度。全螺纹骨螺钉带有螺纹锥形头部,可牢固锁定在固定板上。螺钉的锥形螺纹头设计可防止拔出,并且螺钉在颅侧方向的角度设计可防止螺钉穿透椎体的下终板。
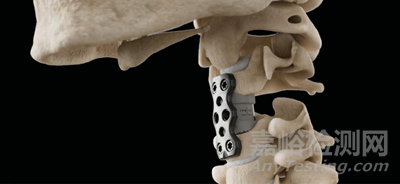
图片来源:ICOTEC AG官网
12、产品英文名称:IFUSE TORQ TNT IMPLANT SYSTEM
产品中文名称:骨盆固定植入系统
企业名称:SI-BONE, INC.
公示日期:2024-08-19
申请号:K241504
适应症范围:主要用于骨盆骨折的固定,包括急性、非急性和非创伤性骨折。
iFuse TORQ TNT系统包括一个完全螺纹的、3D打印的多孔植入物,并配有可选的垫圈,以及用于在透视引导下或与某些导航系统一起放置植入物的仪器。该植入物材料为钛合金,通过3D打印制造而成,具有特定的骨盆解剖结构特点。该设备与其主要的同类产品iFuse TORQ植入系统非常相似,不同之处在于其长度更长(最长可达170毫米)、直径更小,较长的长度使其能够放置在跨髂骨跨骶骨轨迹中。

图片来源:SI-BONE, INC.官网
13、产品英文名称:ALTIUS DIRECT ELECTRICAL NERVE STIMULATION SYSTEM
产品中文名称:植入型神经电刺激器
企业名称:NEUROS MEDICAL, INC.
公示日期:2024-08-26
申请号:P230020
适应症范围:Altius系统是一种可植入的神经调节设备,旨在通过高频交流电流(HFAC)来管理慢性顽固性截肢后疼痛(PAP)。
Altius可植入脉冲发生器(IPG)用于植入腹部,可生成HFAC电刺激(5-10 kHz),并通过刺激导线将电刺激传递到目标神经的植入套筒电极,该电极缠绕在截肢腿部靠近神经断端的目标神经上。研究显示,整个治疗过程仅持续30分钟,患者可根据需要(PRN)自由使用Altius系统治疗疼痛发作。
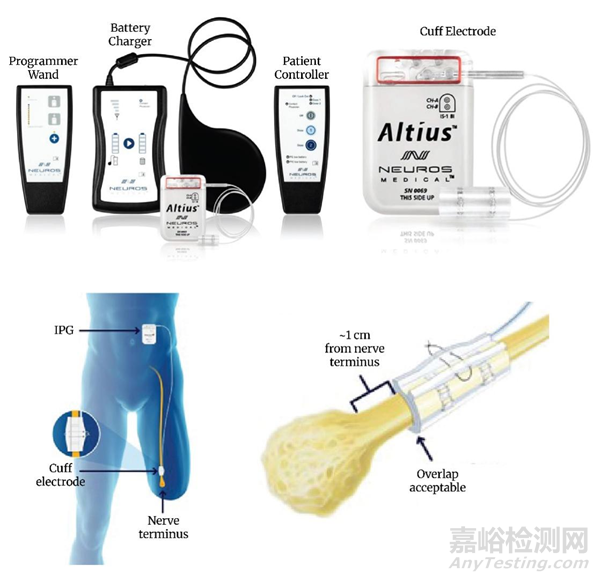
图片来源:NEUROS MEDICAL, INC.官网
14、产品英文名称:MINIMA STENT SYSTEM
产品中文名称:婴幼儿用肺动脉支架
企业名称:RENATA MEDICAL, INC.
公示日期:2024-08-28
申请号:P240003
适应症范围:Minima支架系统适用于治疗新生儿、婴儿和体重至少为1.5公斤的儿童的原发性或获得性肺动脉狭窄或主动脉缩窄。
Minima支架是一种气囊扩张、可透射X光、对称的钴铬(CoCr)支架。该支架使用环氧乙烷气体进行灭菌,并预先压缩安装在Minima输送系统气囊上进行包装。该支架具有独特的单元设计,可通过适当大小的气囊导管重新扩张,最大能够扩展到24毫米的直径。但与此同时,支架长度会减少,因此具体情况需参照使用说明。
图片来源:RENATA MEDICAL, INC.官网
附:FDA突破性器械说明
获得突破性器械的条件是申请上市前批准(PMA)、上市前通告 (510(k)) 或 DeNovo指定的器械产品,需同时符合以下两个条件,其中第二个条件至少满足一条。

资料来源:美国FDA官网

来源:药智医械


