您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-22 10:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
君实双抗体疗法获批扩大新冠EUA。FDA日前扩大君实生物埃特司韦单抗(etesevimab)及巴尼韦单抗(bamlanivimab)双抗体疗法的紧急使用授权(EUA)范围,新增用于特定人群暴露后预防以防止新冠病毒感染。据悉双抗体疗法在对抗Delta突变型及Alpha突变型试验中均保持中和活性。FDA此前已授权这款双抗体疗法紧急使用,用于治疗伴有进展为重度COVID-19住院风险的12岁及以上轻中度COVID-19患者。
国内药讯
1.特瑞普利单抗治疗食管癌Ⅲ期临床积极。君实生物在ESMO2021年会上首次公布特瑞普利单抗联合化疗一线治疗晚期或转移性食管鳞癌的Ⅲ期临床(JUPITER-06研究)积极结果。经BICR评估,与安慰剂相比,特瑞普利单抗将疾病进展或死亡风险降低42%(HR=0.58),两组中位PFS分别为5.7个月和5.5个月。与化疗相比,特瑞普利单抗联合化疗显著延长患者的总生存期(中位OS为17.0个月vs11.0个月),将死亡风险降低42%(HR=0.58)。临床中未发现新的安全性信号。
2.基石CTLA-4联合PD-1早期临床积极。基石药业在ESMO2021年会上公布CTLA-4单抗CS1002与PD-1单抗CS1003联用治疗晚期实体瘤的Ⅰb期研究(CS1002-101)初步结果。在未接受过抗PD(L)1治疗的MSI-H/dMMR实体瘤患者和经抗PD(L)1治疗失败的黑色素瘤患者中,联合疗法总体客观缓解率均达到50%,未观察到剂量限制性毒性,未达到最大耐受剂量(MTD)。
3.科济CLDN18.2-CAR-T早期临床结果积极。科济药业在ESMO2021会议上公布其靶向Claudin18.2(CLDN18.2)的自体CAR-T疗法CT041治疗实体瘤的Ⅰ期临床积极结果。CT041在所有患者和胃癌患者中的总体ORR分别为48.6%和57.1% 。在既往至少2线治疗失败、接受2.5×108CAR-T细胞治疗的18例胃癌患者中,总体ORR为61.1%(11/18),中位PFS为5.4个月,中位OS为9.5个月。所有患者均发生≥3级血液学毒性,未观察到治疗相关的神经毒性、死亡和3级或以上细胞因子释放综合征。
4.康宁杰瑞PDL1/CTLA-4双抗获批临床。康宁杰瑞重组人源化PDL1/CTLA-4双抗Fc融合蛋白注射液KN046获国家药监局临床试验默示许可,用于治疗晚期非小细胞肺癌。KN046已在澳大利亚和中国开展覆盖非小细胞肺癌、三阴乳腺癌、食管鳞癌、肝癌、胸腺癌、胰腺癌等10余种肿瘤的近20项不同阶段临床试验。FDA基于在澳大利亚和中国取得的临床试验结果,批准KN046在美国直接进入II期临床。目前KN046的四项注册临床试验正在进行中。
5.恒瑞与启愈生物达成临床合作。恒瑞VEGFR-2抑制剂阿帕替尼拟与启愈生物claudin 18.2/PD-L1双抗Q-1802开展一项II期临床,评估联合治疗晚期胃癌的有效性和安全性。阿帕替尼是全球首个在晚期胃癌被证实安全有效的小分子抗血管生成靶向药物,也是国内获批上市的胃癌靶向药物中唯一的口服制剂。恒瑞目前正在全球同步开发阿帕替尼联合用药的临床研究,正在一项国际III期临床中评估卡瑞利珠单抗联合阿帕替尼一线治疗晚期肝细胞癌的潜力。
国际药讯
1.Keytruda治疗食管癌获NICE批准。英国国家健康与护理卓越研究所(NICE)批准默沙东PD-1疗法Keytruda(pembrolizumab)纳入国家医疗保障系统,联合化疗一线治疗不适合手术切除或放化疗的转移性或局部晚期食管或胃食管交界癌患者。在一项III期临床试验KEYNOTE-590(NCT03189719)中,与化疗相比,Keytruda联合化疗显著改善患者的总体生存期(OS)和无进展生存期(PFS),两组中位OS分别为12.4个月和9.8个月,中位PFS分别为6.3个月和5.8个月。
2.卡博替尼获FDA批准新适应症。FDA批准Exelixis公司酪氨酸激酶抑制剂卡博替尼(cabozantinib,Cabometyx)扩展适应症,用于治疗接受VEGFR疗法后进展、不适合放射性碘治疗的局部晚期或转移性分化型甲状腺癌(DTC)患者。在一项关键性Ⅲ期临床COSMIC-311中,中位随访时间为10.1个月时,卡博替尼组的中位无进展生存期(PFS)为11.0个月,安慰剂组为1.9个月(HR=0.22,95% CI:0.15-0.31)。具体结果已在ESMO大会上公布。
3.JAK1抑制剂治疗UC获欧盟支持。欧洲药品管理局人用药品委员会推荐批准Galapagos公司JAK1抑制剂Jyseleca(filgotinib)的补充上市申请,用于治疗中/重度活动性溃疡性结肠炎(UC)患者。在一项Ⅱb/Ⅲ期临床SELECTION中,filgotinib在生物制品初治患者中的ORR显著高于安慰剂组(26.1%vs15.3%,p=0.0157);在生物制品经治患者中的ORR也显著提高(11.5%vs4.2%,p=0.0103)。详细结果发表在《柳叶刀》杂志上。
4.诺华CDK4/6抑制剂联合疗法临床积极。诺华在ESMO 2021大会上公布CDK4/6抑制剂Kisqali(ribociclib)与来曲唑(letrozole)联用,治疗绝经后HR+/HER2-的晚期或转移性乳腺癌患者的Ⅲ期临床最终结果。在中位随访超过6.5年时,与安慰剂和letrozole联用相比,Kisqali组合将中位总生存期延长1年以上(中位OS:63.9个月vs51.4个月,HR=0.76,95%CI:0.63-0.93);与letrozole相比,Kisqali组合将患者需要开始接受化疗的时间推迟12个月(HR=0.75,95% CI: 0.61-0.91)。
5.TROP2-ADC治疗肺癌初步结果积极。第一三共制药与阿斯利康在ESMO 2021年会上发布联合开发的TROP2-ADC新药datopotamab deruxtecan(DS-1062),在携带特定基因组变异(包括EGFR突变:85%;ALK融合:9%;ROS1融合:3%和RET融合:3%)的晚期非小细胞肺癌(NSCLC)患者中的初步结果。在34例可评估患者中,DS-1062确认的客观缓解率(ORR)为35%,疾病控制率(DCR)为41%。中位随访为13.4个月时,中位缓解持续时间(DOR)为9.5个月(95% CI:3.3-NE)。
6.KRAS抑制剂联合EGFR抗体治疗CRC数据公布。Mirati公司在ESMO大会上公布KRAS G12C抑制剂adagrasib(MRTX849)单药,或者与EGFR抑制剂Erbitux联用,治疗KRAS G12C突变的结直肠癌(CRC)经治患者的临床数据。adagrasib在可评估患者中的ORR为22%,DCR为87%,中位DOR为4.2个月,中位PFS为5.6个月。adagrasib联合Erbitux治疗的ORR为43%,DCR为100%。在安全性方面,与单药和组合疗法相关的3/4级不良事件发生率分别为30%和16%。
7.PD-L1抑制剂治疗ES-SCLC长期疗效积极。阿斯利康在ESMO大会上公布PD-L1抑制剂Imfinzi(durvalumab)与化疗联用,一线治疗广泛期小细胞肺癌(ES-SCLC)Ⅲ期临床的长期疗效结果。在中位随访超过3年时,与化疗相比,Imfinzi组合将患者死亡风险降低29%,两组的中位OS分别为12.9个月和10.5个月(HR=0.71,95% CI,0.60-0.86)。Imfinzi组合治疗组估计有17.6%的患者在3年时仍然活着(vs5.8%)。所有患者亚群都获得一致的生存获益。
8.FDA专家组否决辉瑞疫苗加强针计划。当地时间9月17日,FDA的专家顾问小组以16比2的投票结果,否决了为16岁及以上的人群注射辉瑞新冠疫苗加强针的上市申请,该小组已将投票结果提交FDA进行最终决定。据该小组成员认为,老年人、脆弱人群可能会受益于加强针,但是加强针是否对年轻群体有效的数据不足。
医药热点
1.全国新冠核酸检测再次降价。国家医保局日前宣布,近期指导各地医疗保障部门降低公立医院核酸检测价格,在今年1月降价基础上进一步降低全国新冠病毒核酸检测费用。截至9月16日,已有广东、湖北、上海、天津、河北等共计30个省份下调公立医院新冠病毒核酸检测价格,绝大多数省份将单人单检价格降至每人份60元或更低水平,10人混检价格降至每人份15元或更低水平。
2.消除丙肝危害今年要实现3个100%。国家卫健委等9部门联合印发的《消除丙型肝炎公共卫生危害行动工作方案(2021—2030年)》提出,今年内,二级及以上综合医院、传染病专科医院、各级疾控机构要100%具备丙肝抗体和核酸检测能力,全国临床用血丙肝病毒核酸检测率达100%,医疗机构安全注射比例达100%。到2030年,新报告抗体阳性者的核酸检测率达95%,符合治疗条件的慢性丙肝患者的抗病毒治疗率达80%。
3.每年近两百万人死于职业病及职业伤害。9月17日,世卫组织和国际劳工组织发布联合报告,指出全球每年有近200万人死于职业相关疾病及伤害。两个组织研究了全球在2000年至2016年期间工作与死亡和伤害的关系,发现81%的死亡个案都与非传染性疾病有关,其中75万名死者与工时长(即每周工作时间55小时或以上)有关。
评审动态
申请临床:
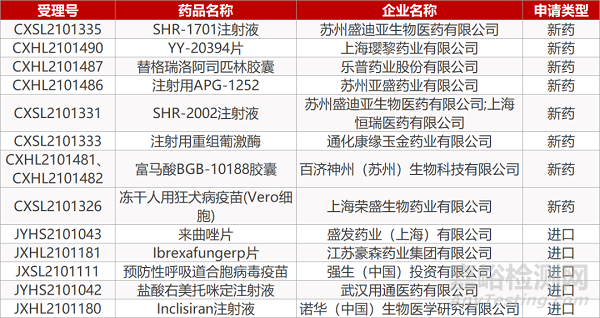
苏州盛迪亚的SHR-1701注射液、上海璎黎的YY-20394片、乐普药业的替格瑞洛阿司匹林胶囊、苏州亚盛药业的注射用APG-1252、苏州盛迪亚/上海恒瑞的SHR-2002注射液、通化康缘玉金药业的注射用重组葡激酶、百济神州的富马酸BGB-10188胶囊(2个规格)、上海荣盛生物的冻干人用狂犬病疫苗(Vero细胞)、江苏豪森的Ibrexafungerp片、强生的预防性呼吸道合胞病毒疫苗、诺华(中国)的Inclisiran注射液。
申请生产:
盛发药业的来曲唑片、武汉用通医药的盐酸右美托咪定注射液。

来源:药研发


