您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-03 11:36
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
康诺亚MASP-2单抗获批临床。康诺亚生物MASP-2靶向单抗CM338获国家药监局临床试验默示许可,拟开发用于IgA肾病的治疗。CM338是康诺亚生物拥有全球自主知识产权的1类创新药,也是国内首个获批进入临床阶段的同靶点药物。在临床前研究中,CM338作用机制清楚,体内及体外药效明显,同时具有较高的亲和力及体外抑制活性,最高逾30倍。毒理学研究结果也显示安全性特征良好。
国内药讯
1.泽璟外用重组人凝血酶III期临床成功。泽璟制药外用重组人凝血酶(人丝氨酸蛋白酶)的III期临床(ZGrhT002)达到主要终点指标。该项研究评价重组人凝血酶在肝脏切除术后毛细血管和小静脉渗血/小出血的辅助治疗及任何常规外科止血无效或不适用时的止血疗效。试验共计划入组约510例患者,详细数据将在学术大会上公布。据悉,这是国内唯一采用重组基因技术生产的人凝血酶产品,全球同类产品仅有BMS的Recothrom在境外上市。
2.祐和医药CD40单抗国际Ⅱ期临床获批。百奥赛图旗下祐和医药抗CD40单抗YH003注射液获NMPA临床许可。这是一项国际Ⅱ期多中心临床试验,将在美国、澳大利亚及中国评估YH003联合特瑞普利注射液治疗不可切除/转移性黑色素瘤和胰腺导管腺癌患者的安全性和有效性。在澳洲开展的I期剂量递增研究(YH003003)中,13例可评估患者有2例达到部分缓解(PR),3例达到疾病稳定(SD)。临床中无药物相关性SAE发生。
3.苏州康乃德S1P1调节剂报IND。苏州康乃德生物1类化学新药CBP-307胶囊的临床试验申请获CDE受理,拟用于自身免疫疾的治疗。CBP-307为一款新型的口服S1P1调节剂,临床前研究表明该药对多种自身免疫疾病安全、有效,具有更高的选择性,对中重度溃疡性结肠炎/克罗恩病患者具有较好的疗效与耐受性。CBP-307未来也有望开发成治疗多发性硬化症(MS)的新药。
4.再鼎KRAS G12C抑制剂报IND。再鼎医药KRAS G12C抑制剂MRTX849片(adagrasib)的临床试验申请获CDE受理。Adagrasib是Mirati公司开发的一款小分子新药,再鼎拥有其在中国内地、香港、澳门和台湾开发和独家商业化权利。在美国,FDA已于6月授予adagrasib突破性疗法认定,用于治疗携带KRAS G12C突变且既往接受过系统性治疗的非小细胞肺癌(NSCLC)患者。Mirati计划年内向FDA递交上市申请。
5.复宏汉霖EGFR/4-1BB双抗报IND。复宏汉霖EGFR/4-1BB双抗HLX35的临床试验申请获CDE受理。这也是国内首款申报临床的EGFR/4-1BB双抗,拟用于治疗结直肠癌和头颈部肿瘤等实肿瘤。在临床前研究中,HLX35既可与肿瘤表面的EGFR分子结合,阻断肿瘤信号传导通路,杀死肿瘤细胞;还可结合免疫细胞(T细胞和NK细胞)表面上的4-1BB免疫激活分子,从而协同杀死肿瘤细胞,提高疗效。
国际药讯
1.辉瑞/BioNTech新冠疫苗获批儿童EUA。辉瑞与BioNTech联合开发的COVID-19疫苗Comirnaty(tozinameran、BNT162b2 )获FDA紧急使用授权,用于在5-11岁儿童中接种,预防新冠肺炎感染。Comirnaty是美国目前唯一可用于5-11岁的COVID-19疫苗。在一项II/III期临床中,该疫苗在未感染过SARS-CoV-2的儿童受试者中表现出良好的安全性和强大的免疫反应,保护效力高达90.7%。试验中未发现与疫苗相关的任何严重安全问题。
2.创新PI3Kδ抑制剂获FDA优先审评。FDA受理ncyte公司新一代PI3Kδ口服抑制剂parsaclisib的新药申请(NDA),用于治疗复发/难治性滤泡性淋巴瘤、边缘区淋巴瘤和套细胞淋巴瘤患者。FDA同时授予parsaclisib优先审评资格,用于治疗接受过至少一种CD20抑制剂治疗的复发/难治性边缘区淋巴瘤成人患者,以及经治套细胞淋巴瘤成人患者。信达生物拥有parsaclisib在大中华区的开发和商业化权利。
3. 杨森IL-23抑制剂长期疗效积极。杨森IL-23抑制剂Tremfya(guselkumab)治疗活动性银屑病关节炎(PsA)的Ⅲ期临床最新数据积极。第52-100周的随访结果显示,Tremfya治疗组患者放射学评分的平均变化显著改善,显示放射学进展率较低;大部分患者达到并维持强直性脊柱炎疾病活动评分的显著改善,多种患者关节的轴性症状、指趾炎等均具有持久的改善;而且在活动性PsA(随访2年)和中重度斑块状银屑病(随访5年)患者之间Tremfya呈现出一致的安全性特征。
4.诺华布局下一代口服靶向蛋白降解疗法。诺华与Dunad Therapeutics将利用后者可调谐(tunable)和高选择性的平台,针对诺华指定的多达4个药物靶点,合作开发新型共价和靶向蛋白降解小分子候选药物。根据协议,Dunad将获得研究经费、2400万美元的预付款、股权投资和总额可达13亿美元的里程碑后付款,以及产品的销售分成;诺华将拥有开发和商业化产品的独家选择权。
5.默沙东布局特异性细胞因子疗法。默沙东与Synthekine公司将利用后者替代细胞因子激动剂技术平台合作开发、生产和商业化用于自身免疫性疾病和癌症的新型细胞因子候选治疗药物。根据协议,Synthekine将获得研究经费、高达5.25亿美元的开发、监管和商业化里程碑后期付款,以及产品的销售分成;默沙东将拥有最多两个靶点的替代细胞因子激动剂的开发、生产和商业化权益。
6.阿斯利康终止DNA癌症疫苗合作协议。阿斯利康全球生物制剂研发部门MedImmune宣布终止与Inovio公司关于DNA癌症疫苗INO-3112(MEDI0457)的合作开发协议。MEDI0457拟开发用于治疗由16型和18型人乳头瘤病毒(HPV)引起的癌症。目前该疫苗正在II期临床中用于治疗头颈部鳞状细胞癌(HNSCC),预计2022年底前完成临床研究报告。MedImmune将继续赞助这项研究,直到研究结束。
医药热点
1.君实生物任命医学科学副总裁。君实生物宣任命Virginia Ellen Maher博士为医学科学副总裁,负责公司临床开发项目全周期的策略制定、指导和监督等工作,向公司首席医学官(CMO)Patricia Keegan博士汇报。在加入君实生物之前,Maher博士在生物制药监管咨询公司DataRevive担任执行总监和首席临床顾问。在此之前,Maher博士在FDA工作近20年。
2.四川拟制定短缺药品清单。四川省卫健委等7部门印发《四川省短缺药品清单管理办法(试行)的通知》,要求制定全省短缺药品清单和临床必需易短缺药品重点监测清单。《通知》明确提出,全省药品上市许可持有人停止生产的,应当在停产6个月前向省药监局进行停产报告;发生非预期停产的,在3日内报告。
3.福建深化公立医院薪酬制度改革。福建省日前印发《福建省深化公立医院薪酬制度改革实施方案》指出,在完善公立医院薪酬总量管理方面,包括完善水平决定机制、健全倾斜支持措施、落实人才激励政策、建立动态追加机制四方面内容,将赋予公立医院更大的内部自主权。“十四五”期间,力争将人员支出占公立医院业务支出的比重总体提高至45%左右。
评审动态
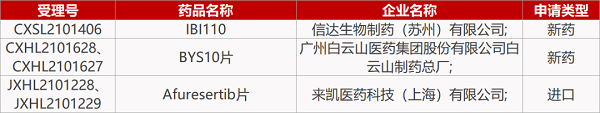
1. CDE新药受理情况(11月02日)

来源:药研发


