您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-01-10 21:02
刚刚过去的2021年,是国家正式启动仿制药一致性评价工作以来的第6个年头。
CPM新药研发监测数据库数据显示,在这一年里,共有573家企业1965个品规的仿制药通过一致性评价或视同通过一致性评价,同比增长超过70%。截至2021年底,累计共652个品种(以通用名+剂型计,下同)通过一致性评价(含视同通过,下同),涉及780+家企业3700+个批文。下面我们一起来看看,这一年来一致性评价过评与申报有些怎样的变化?又能带给我们什么样的启示?
首次过评品种含量下降
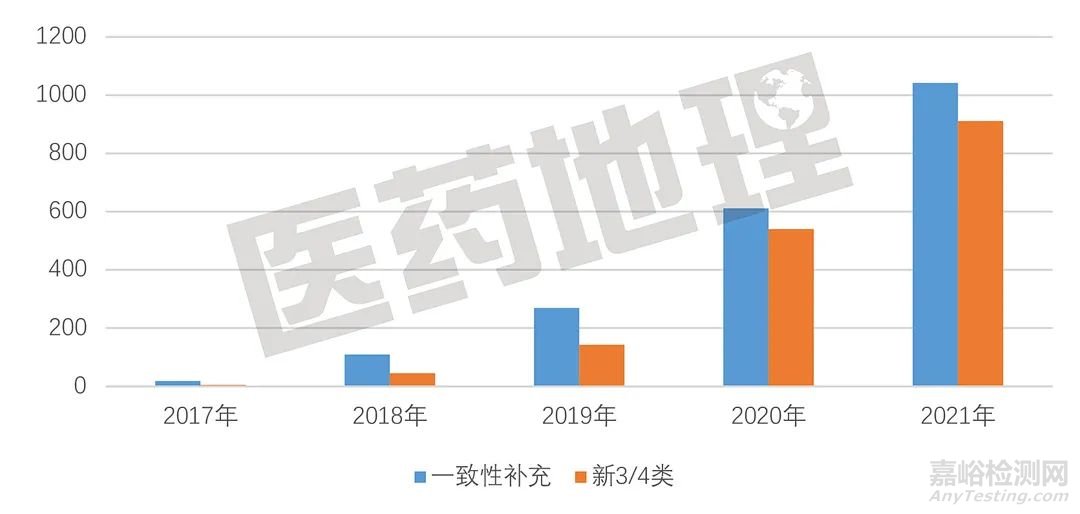
2021年度,累计过评品种数从年初的426个增加至年末的652个,也即本年度获批的近2000个过评仿制药批文中,含首次过评品种226个。而在上一年度,获批的过评仿制药批文数不到2021年的6成,但其中首次过评品种数达到了215个,仅比2021年略低。
首次过评品种含量的下降,说明新获批的过评仿制药更多地集中到一些已经有企业过评的品种上,一些热门品种扎堆过评,与此同时,大量仿制药品种无企业开展一致性评价工作。长此以往,势必造成大量仿制药品种退出市场,由此可能带来的临床药品短缺风险,值得关注。
图1. 过评批文数年度变化趋势
过评注射剂占比翻倍
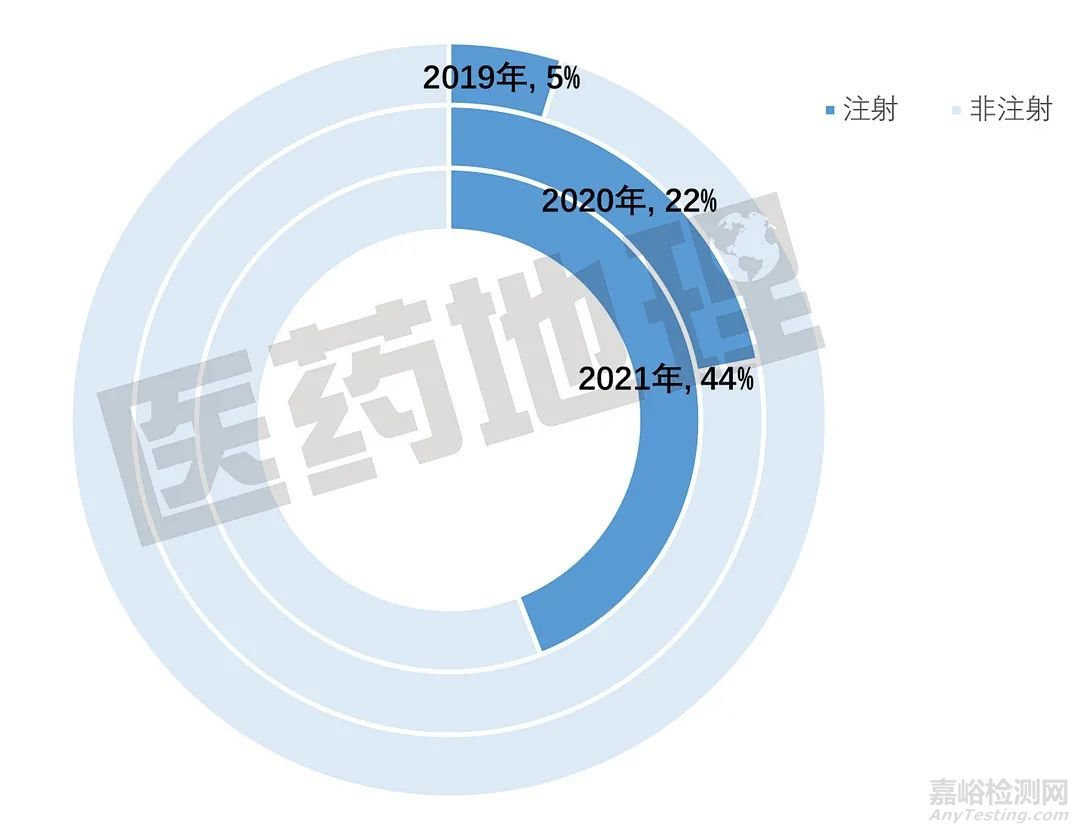
2021年度获批的过评仿制药批文中,注射剂型批文数占比达到44%,正好是上一年度的一倍。2020年年中是国家正式启动注射剂一致性评价工作的时间,因此,出现这一结果也是顺理成章。
图2. 过评仿制药剂型分布
一致性补充申请和新3/4/5.2类申请数量
一降一升,走势迥异
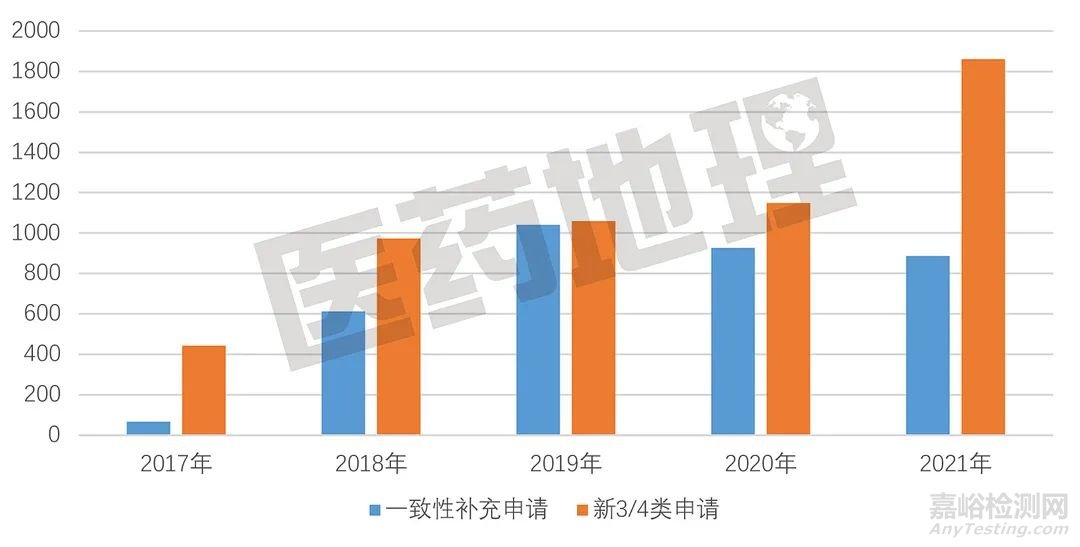
从仿制药一致性评价申报情况来看,2021年度CDE承办的受理号总量同比大幅增长,涨幅超过30%,同样超过上一年度。不过,其中的一致性补充申请和新3/4/5.2类申请,呈现出截然相反的走势。在仿制药批文整体过评率不到5%且政策条件已经较为明朗的背景下,一致性补充申请量自2019年后逐年下降,而新3/4/5.2类申请逐年上升,反映出仿制药企业更倾向选择开展仿制药新项目研发,而不是旧标准仿制药的过评。
确实,在医保控费和医药集采之下,仿制药暴利时代一去不复返,有限的资源不宜浪费在过时老化品种上,只有积极拓展产品线,发展高仿、难仿和首仿药,开展临床急需、供应短缺、疗效确切、新专利到期药物的仿制开发,才能抢占新市场,获得更多发展机会。
图3. 仿制药一致性评价申请受理量年度变化趋势

来源:医药地理


